

近日,上海交通大学吴龙飞课题组联合芝加哥大学的Jack W. Szostak课题组,成功揭示了生命起源初期,持续的能量驱动下核酶自组装形成的可能途径和机制。此研究为生命起源的RNA世界假说在实验支持上再添一环。相关研究成果以 “Efficient Assembly of Functional RNA by In Situ Phosphate Activation and Loop-Closing Ligation”在线发表于《JACS》。论文第一作者为Szostak课题组的张健博士,吴龙飞博士和Szostak博士为论文的共同通讯作者。
生命起源问题是一个涵盖从天文学,到地球化学、前生命有机化学,到合成生物学和进化生物学等的多学科交叉问题。生命起源的“RNA世界”假说作为众多理论中最广受关注和获得最多证据支持的理论,在过去30年取得了诸多重要的成果。“RNA世界”假说认为,最早的原始细胞中,遗传物质和催化功能均由RNA承担。在理论层面,RNA世界假说将现代生命中DNA和蛋白质分别行使的遗传物质功能和催化功能(基因型和表性的二元分离)统一到RNA分子。在实验层面,“RNA世界”假说的目标是构建一个极简的、可进化的原始细胞体系:原始脂肪酸细胞膜包裹的自复制RNA体系。得益于从随机RNA序列中筛选功能RNA技术的发明和发展,在实验室构建一个自复制的RNA体系已不再遥不可及。但是,本文作者关注一个不可回避的问题:最先的功能性RNA在无复制酶条件下如何自发组装形成。这一问题迄今仍然没有可行的方案
对于最初的核酶如何涌现的问题,一种可能的答案是短链寡聚核酸通过自组装共价连接,产生足够长且具有催化功能的核酸。然而在水环境中如何实现高效的、非酶促RNA连接反应存在诸多挑战。首先,寡核苷酸的5′端磷酸需要进行预活化将其转化为活性的连接前体;但是,5′端磷酸的活化前体因其高活性而会快速水解;其次,RNA的连接反应往往需要高浓度的金属离子的参与,无法与原始的脂肪酸细胞膜体系兼容。另外,传统的RNA连接反应需要模板链的辅助,以实现3′-羟基与5′-磷酸在空间上的临近而发生化学反应。但模板链强烈抑制产物链的折叠而阻碍核酶的功能发挥。因此,寻找原始细胞膜兼容的功能RNA自组装过程对于构建“RNA世界”假说下的自复制体系也至关重要。

图1. 通过原位磷酸活化与关环连接驱动的功能RNA组装。(A) 功能RNA组装的示意图。3′端的亲核羟基以“OH”表示;5′端的磷酸基以“p”表示;活化的5′-磷酰胺咪唑以五边形示意。(B)磷酸原位活化机理:Passerini-type反应
早期研究发现,RNA片段在无模板链存在下也可进行闭环连接反应(Loop-Closing Ligation),直接产生关键的RNA发卡结构(J. Am. Chem. Soc. 2022, 144,13920-13927)。通过进一步的高通量测序方法描绘RNA闭环连接反应的序列-反应性图谱,作者不但发现优势的闭环连接序列比非优势序列的反应活性高出300倍,而且优势反应序列与天然、高频率出现的发卡结构序列高度重合。(Angew. Chem. Int. Ed. 2025, 64, e202417370)。在这些工作的基础上,作者推想:若将RNA闭环连接反应的优势序列结合5′端磷酸原位活化,或可实现功能RNA的高效、多步连续、非酶促自组装(图1)。
甲基异氰蕴含一个高能量的三键,被认为是前生命时期可能的缩合能量来源(Nat. Chem. 2020, 12, 1023; Chem. Commun. 2021, 57, 73)。甲基异腈联合简单的醛类分子可更有效的对磷酸进行活化。通过系统的水相反应优化,作者成功实现了高达96%的RNA闭环连接反应产率以获得RNA发卡结构 (图1A),且所使用的活化试剂浓度可低至5 mM。通过对反应的机理进行研究,作者成功鉴别了一类全新的、水相兼容的磷酸活化关键中间体,N-imidoyl-N′-methylimidazolium。最后,利用最优的原位磷酸活化条件,通过并行的两步闭环连接反应,作者成功实现了Flexizyme核酶接近定量产率的共价连接自组装(图2)。
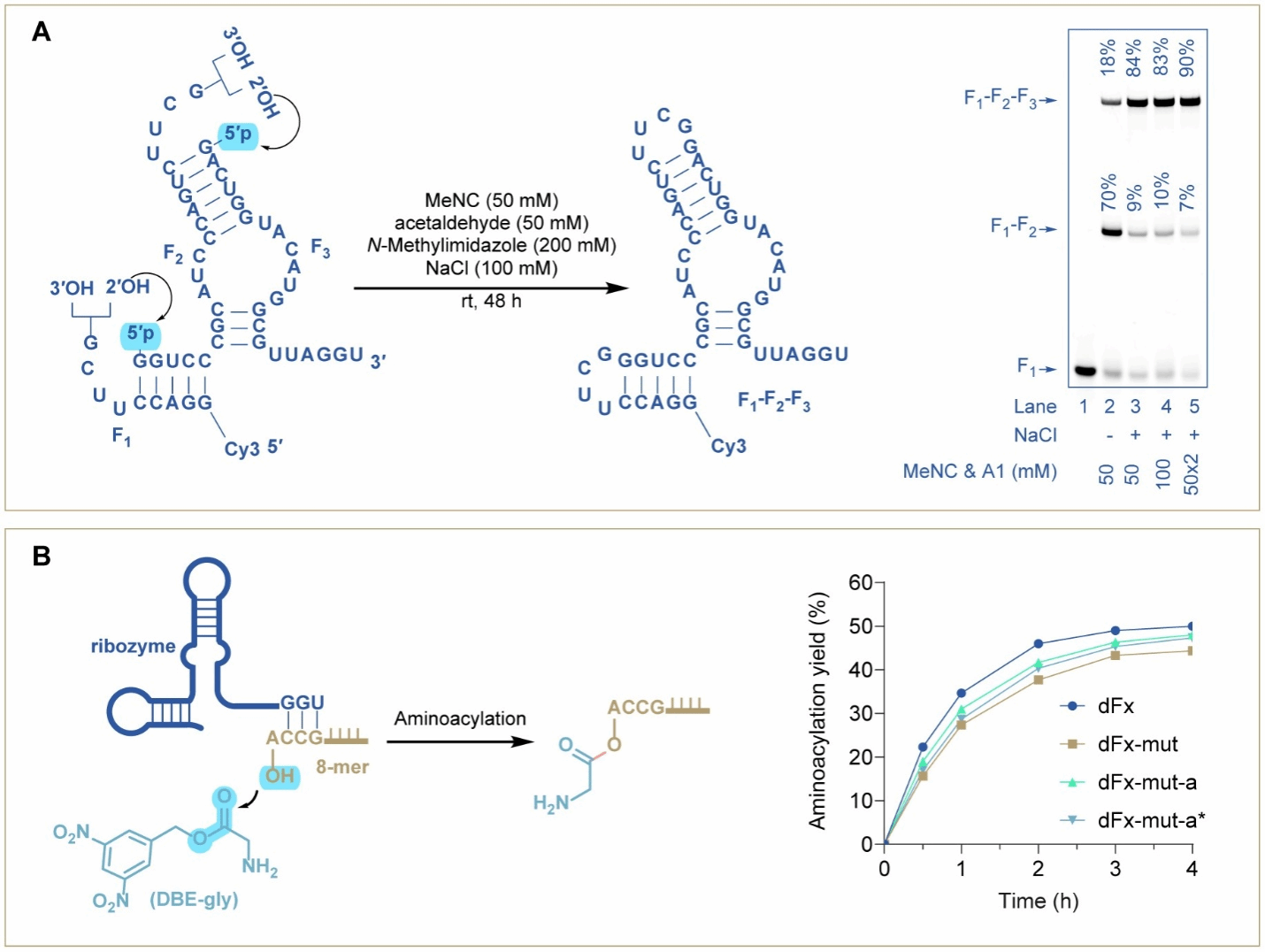
图2. 核酶(Flexizyme)的闭环连接共价自组装与活性评估。
总结:
本研究利用可行的前生命、高能量小分子,成功实现了功能RNA的原位活化、高效共价自组装。组装过程无需外来模板,水相兼容,定量转化且无需二价金属参与。这项研究不但为与原始细胞兼容的功能RNA涌现体系的构建提供了基础,同时也为长链RNA的绿色化学合成提供了新思路。
吴龙飞课题组简介和招聘
吴龙飞课题组以“生命的起源、重构与改造”为根本问题,专注于生物中心法则(DNA→RNA→蛋白质)的化学起源,揭示相关生命诞生早期演化的关键化学过程。同时,致力于负责信息处理的功能生物大分子的进化筛选与理性设计,构建模块化生物功能元件体系。课题组成立前,代表作发表于 Nat. Chem., JACS, Angew. Chem., PNAS 等国际主流期刊。
吴龙飞,2005年获得全国高中生化学竞赛一等奖(湖南赛区)并保送入复旦大学,2010年6月在复旦大学获得药学学士学位;2016年1月在中科院上海有机化学研究所获得博士学位,主要从事天然产物生物合成通路及酶催化反应体外表征的研究(博士导师:唐功利研究员); 2016年4月至2021年4月在英国剑桥的医学委员会分子生物学实验室(MRC-LMB,享有“诺奖工厂”的美誉)进行生命起源相关的博士后工作,研究原始小分子、多肽和RNA的共进化系统化学过程(合作导师:John Sutherland,英国皇家科学院院士,剑桥大学三一学院教授);2021年4月至2024年9月期间,以博士后身份分别在哈佛大学和芝加哥大学继续进行有关功能RNA自组装、进化筛选及原始细胞方向的研究(合作导师:Jack Szostak,美国科学院院士和2009年诺贝尔奖得主)。2024年9月加入上海交通大学变革性分子前沿科学中心,入选国家和上海市青年人才项目,担任课题组长(PI)、长聘教轨副教授。课题组每年招收博士生1-2名,欢迎优秀的学生报名加入。具体报考信息请查询上海交通大学变革性分子前沿科学中心主页招聘板块。
招聘:课题组诚挚邀请具有良好科研基础、研究兴趣和有志进行学术事业发展的博士后加入,开展关于RNA生命起源化学、RNA化学生物学和RNA药物相关方面的交叉研究工作。课题组工作氛围友好、积极向上、资源充足。有兴趣的才俊请邮件lfwu@sjtu.edu.cn, 邮件标题请注明“姓名-博士后申请-毕业学校”。








