

近日,上海交通大学变革性分子前沿科学中心朱峰/杨波团队联合仁济医院朱利娟研究员,在多肽和蛋白质的精准类金属化修饰研究中取得重要进展。相关研究成果以“Photocatalyzed Decarboxylative B-C Couplings for the Synthesis of Carboranyl Amino Acids and Peptides”为题发表在发表于国际著名期刊JACS上。上海交通大学变革性分子前沿科学中心博士生周正红为论文第一作者。
硼中子俘获治疗(BNCT)作为肿瘤治疗的“第五种模式”,以其能够选择性杀死癌细胞并保护健康组织的特点,成为肿瘤学领域的重要突破。该治疗依赖于将硼-10(¹⁰B)选择性递送至肿瘤细胞,随后通过热中子照射引发核反应,产生高能α粒子和⁷Li核,由于其极短的射程,可精确消融肿瘤细胞而不损伤周边正常组织。然而,BNCT的成功高度依赖¹⁰B在肿瘤中的高效与选择性蓄积。现有硼递送剂,如第一代的硼酸衍生物及第二代的BPA和BSH,均因靶向性不足、硼载量低或代谢过快等问题,限制了治疗效果。因此,开发兼具高硼负载与优异肿瘤选择性的第三代硼递送剂成为当务之急。碳硼烷因其超高的硼含量、良好的生物相容性、稳定的化学性质及独特的立体芳香性,成为理想的硼载体。例如,硼化二肽BG在治疗脑肿瘤中已展现出良好的肿瘤蓄积与治疗效果。更引人注目的是,碳硼烷可作为苯环的生物电子等排体,通过结构替换(如将L-苯丙氨酸替换为L-碳硼烷丙氨酸)引入新颖的物化特性,进而优化药物动力学性质。多肽类载体凭借其对肿瘤受体高亲和力、低免疫原性等优势,成为第三代硼递送系统的重要方向。当前碳硼烷多肽的合成主要依赖碳顶点官能化策略,而硼顶点(B–H键)的选择性修饰因化学惰性高、反应选择性难控制而极具挑战,但其能够提供与碳顶点相反的电子效应,为构效关系研究和药物设计开辟新路径。
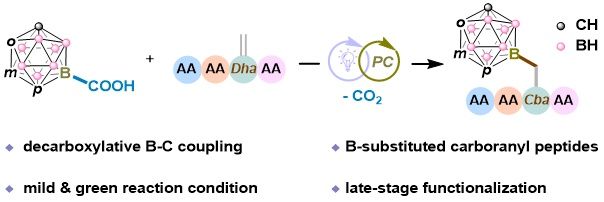
上海交通大学变革性分子前沿科学中心朱峰课题组长期致力于糖类化学合成与蛋白质化学修饰研究,围绕糖基/肽基金属试剂参与的过渡金属催化交叉偶联反应开展特色探索,发展了一系列高效、精准的糖类、多肽及蛋白质合成方法(Chem 2025, doi:10.1016/j.chempr.2025.102713; ACIE 2025, doi:10.1002/anie.202511045; ACIE 2025, 64, e202504504; Nat. Commun. 2024, 15, 5228; ACIE 2023, 62, e202314832; ACIE 2022, 61, e202207153; Chem Catal. 2021, 1, 870等)。针对上述挑战,近日,上海交通大学变革性分子前沿科学中心朱峰/杨波团队与仁济医院朱利娟副研究员合作,首次实现了可见光介导的B–C交叉偶联反应,成功将硼功能化碳硼烷羧酸位点选择性地引入含脱氢丙氨酸(Dha)的多肽中。该方法条件温和、产率高、官能团兼容性好,可高效构建B-顶点取代的碳硼烷-多肽缀合物。团队还合成了手性纯的B-取代碳硼烷丙氨酸,并验证了其在多肽固相合成中的稳定性与应用潜力。此外,该方法进一步拓展至DNA-多肽缀合物的构建,成功制备了具有高效靶向与内化能力的核酸适配体-碳硼烷复合物,为BNCT的靶向递送提供了新平台。该研究不仅推动了B-顶点功能化碳硼烷肽的合成,也为开发新一代高选择性、高稳定性的BNCT硼递送剂奠定了坚实基础。
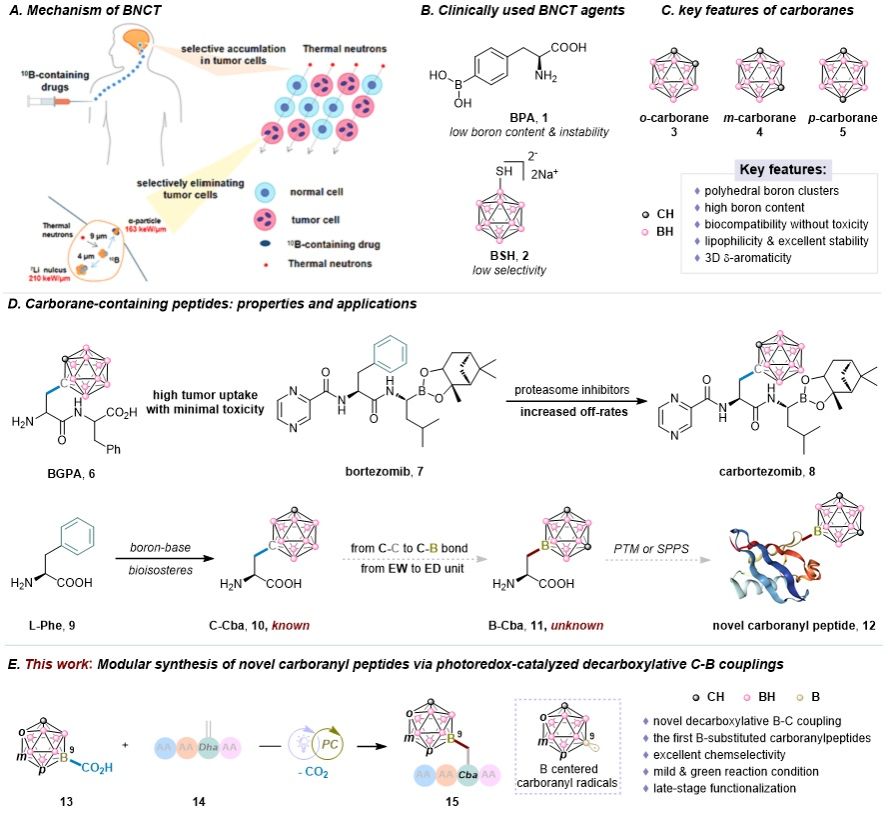
图1. 研究背景
作者首先对反应条件进行了系统优化(表1)。结果发现,以硼功能化的间位碳硼烷羧酸13a和N-Boc保护脱氢丙氨酸14a为模型底物,以Ir[dF(CF₃)ppy]₂(dtbbpy)PF₆ PC1为光催化剂,以Cs₂CO₃为碱,MeCN为溶剂,在18 W紫光LED照射下,45 ℃反应24 h,以89%的NMR产率和86%的分离产率得到了预期的B-C偶联产物。
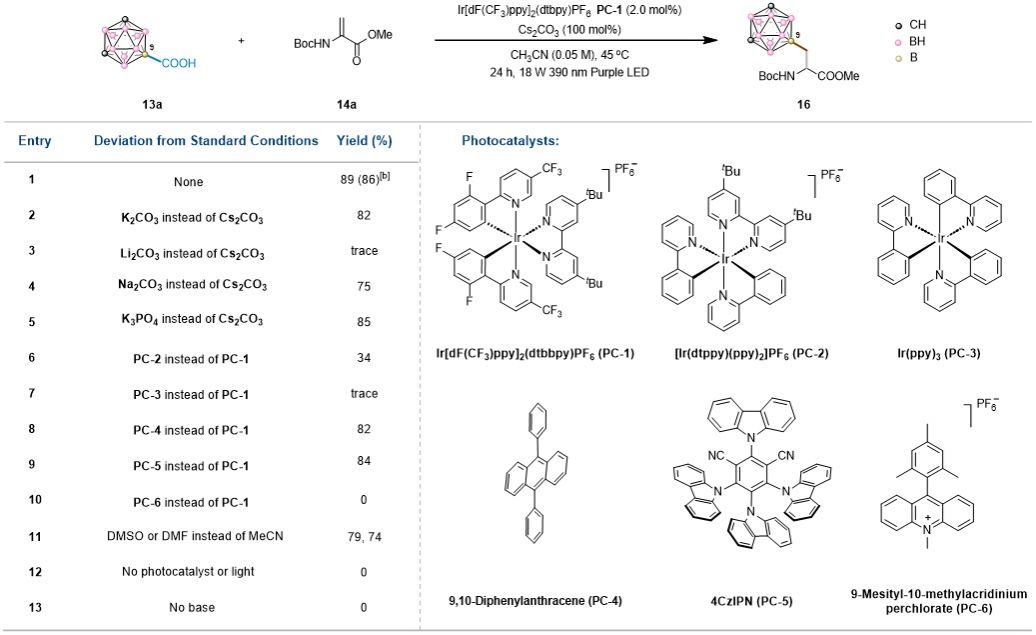
表1. 反应条件优化
在优化的光催化脱羧偶联条件下,该反应对多种不同长度与序列的多肽底物均表现出良好兼容性,可高效构建B-顶点碳硼烷氨基酸及多肽衍生物。使用手性Karady–Beck型脱氢丙氨酸(D型或L型)时,反应收率高且非对映选择性优异(d.r. > 20:1),其立体化学由手性辅基精确控制;而无手性辅助时则生成1:1的非对映异构混合物,表明该策略能够有效实现立体可控的碳硼烷丙氨酸合成。
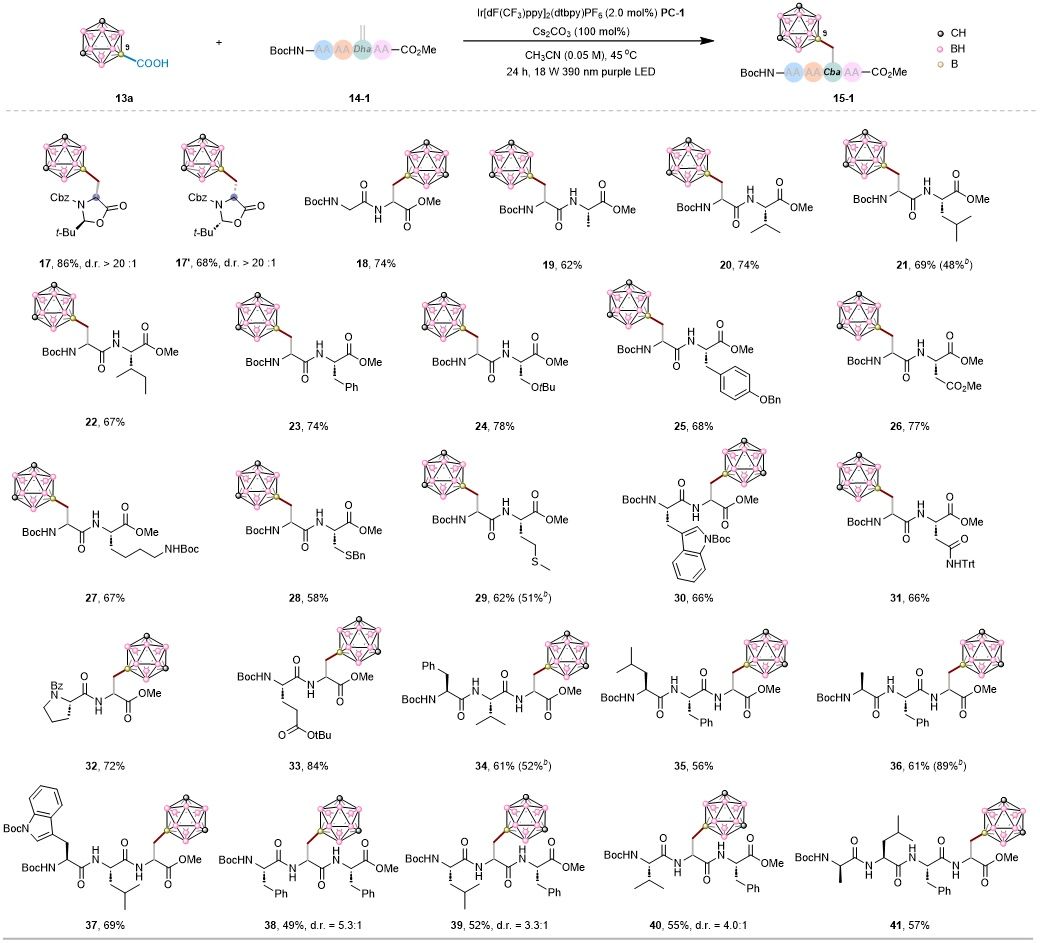
图2. 含Dha底物范围
接下来,作者以手性Karady-Beck脱氢丙氨酸对硼官能化碳硼烷羧酸的反应范围进行了考察(图3)。在优化的反应条件下,一系列在碳原子上带有不同烷基和芳基取代基的碳硼烷羧酸均可以顺利偶联,以良好至高产率和优异的非对映选择性(d.r. > 20:1)得到相应的B-C偶联产物。为了进一步评估该方法的普适性,我们将该反应顺利扩展到硼取代的邻位-碳硼烷羧酸,证明了该脱羧B-C键形成策略具有广泛的官能团耐受性和结构多功能性。
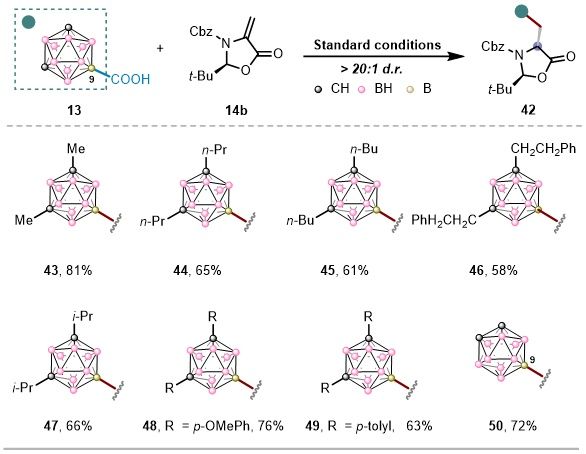
图3. 碳硼烷羧酸底物范围
为展示所开发光催化合成碳硼烷氨基酸和多肽反应的可扩展性,作者开展了系列放大反应、脱保护实验、液相合成以及多肽的固相合成(图4)。利用合成与转化得到了具有生物正交的功能手柄的B-顶点取代的衍生物,适合于下游的点击偶联或化学生物学应用。值得注意的是,碳硼烷部分在强酸性条件(TFA)下保持化学稳定性,这突出了碳硼烷的稳健性。总的来说,这些结果证明了B-Cba是一种通用且稳定的非蛋白氨基酸(NPAA),它完全兼容于溶液相和固相多肽合成,因此在功能化多肽甚至碳硼烷标记的蛋白质中具有广阔的应用前景。
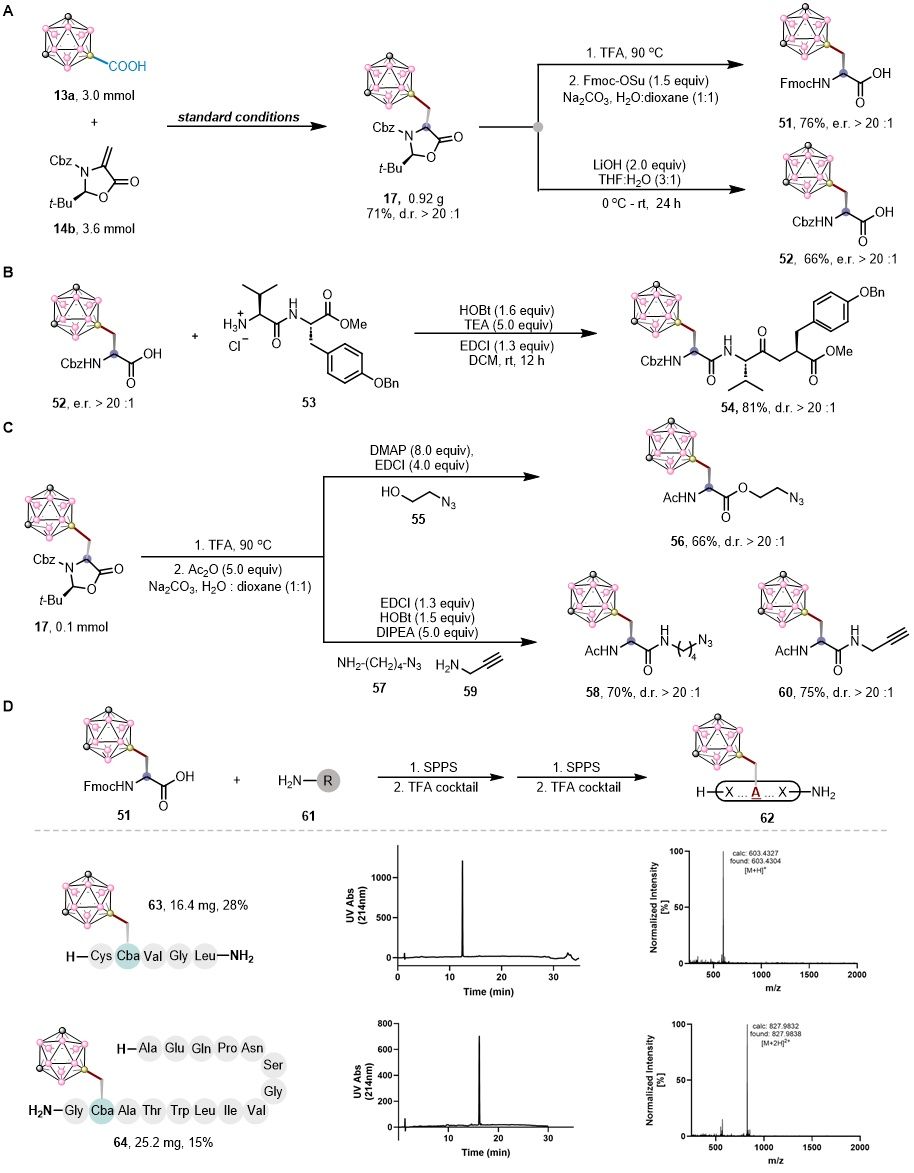
图4. 合成与转化
DNA编码化合物库(DELs)技术结合组合化学与分子生物学优势,利用DNA序列标记化合物,实现高通量筛选,为新药研发提供强大平台。为提升DELs的化学多样性及药物相关性,亟需发展更多DNA兼容的化学反应。碳硼烷因其独特的三维结构、疏水性和药理活性,成为扩展DEL化学空间的重要骨架,尤其含碳硼烷的氨基酸单元,为药物发现及化学生物学应用提供了新途径。为验证该方法,研究者选用铜催化的叠氮-炔环加成反应(CuAAC),以DNA标记的胺为起始物,经炔基羧酸制备DNA标记炔烃,进而与手性碳硼烷叠氮一锅法反应,成功构建碳硼烷-氨基酸-DNA缀合物。该策略适用于多种(杂)芳基炔底物,并可通过反向方式使DNA叠氮与碳硼烷炔烃高效偶联,在宽泛的芳基与烷基叠氮底物中均表现出良好官能团耐受性和中高转化率。该研究建立了一种通用、高效的DNA兼容方法,可通过氨基酸连接子将碳硼烷结构引入DEL,显著增强化合物库的结构多样性,为药物研发(包括硼中子俘获治疗及化学生物学领域)拓展了新的化学空间。
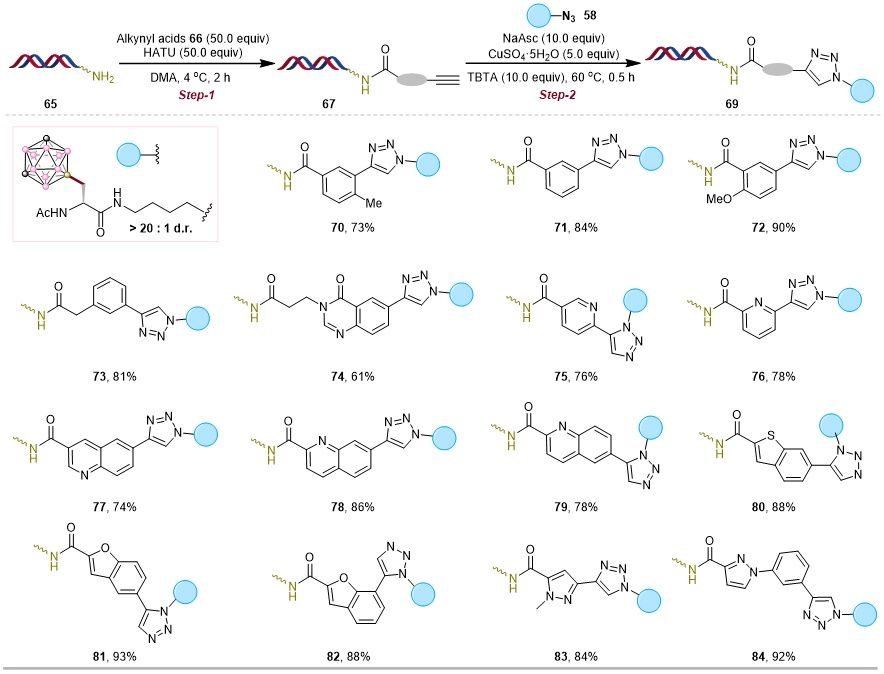
图5. DNA炔基参与的环加成反应
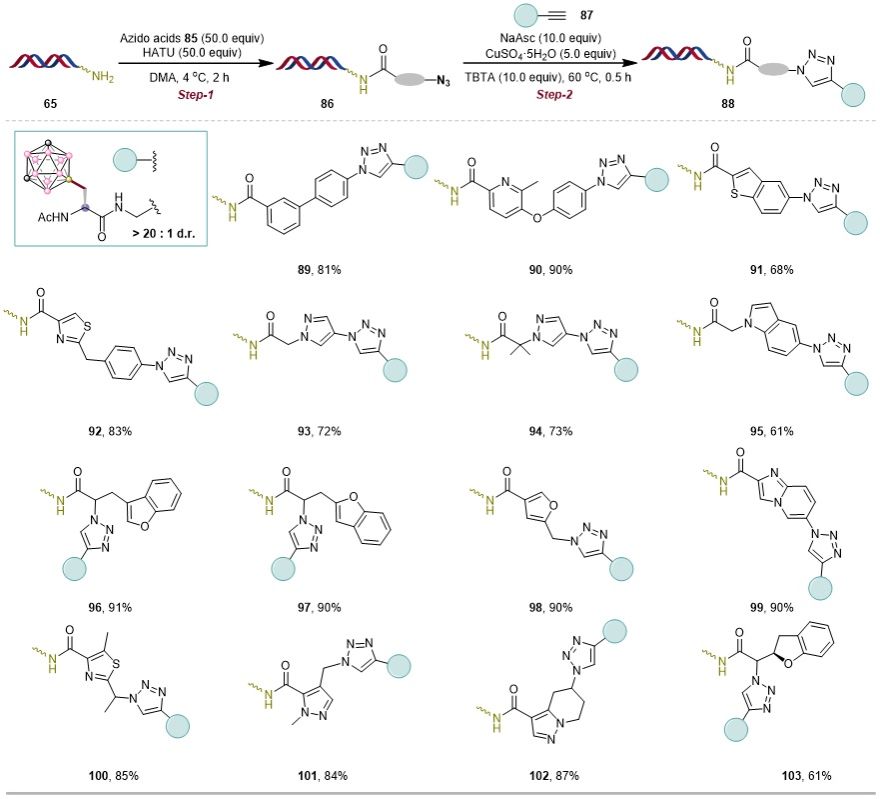
图6. DNA叠氮参与的环加成反应
硼中子俘获治疗(BNCT)的效果依赖于¹⁰B在肿瘤中的选择性积累。为实现靶向递送,本研究采用对上皮细胞粘附分子(EpCAM)具有高亲和力的核酸适配体作为载体,通过点击化学将B-顶点取代的碳硼烷丙氨酸衍生物与之共价连接,构建了靶向偶联物FAM-EpCAM-B。凝胶电泳和质谱分析证实了其结构与纯度。在HT29和MDA-MB-231两种EpCAM高表达癌细胞系中,流式细胞术和共聚焦显微镜成像均显示,该偶联物可实现显著增强的细胞内化,且该过程由EpCAM介导。实验结果表明,FAM-EpCAM-B在保留原有靶向能力的同时,实现了有效的硼载体递送,展现出作为BNCT靶向治疗平台的潜力,并有望拓展至更广泛的化学生物学应用领域。
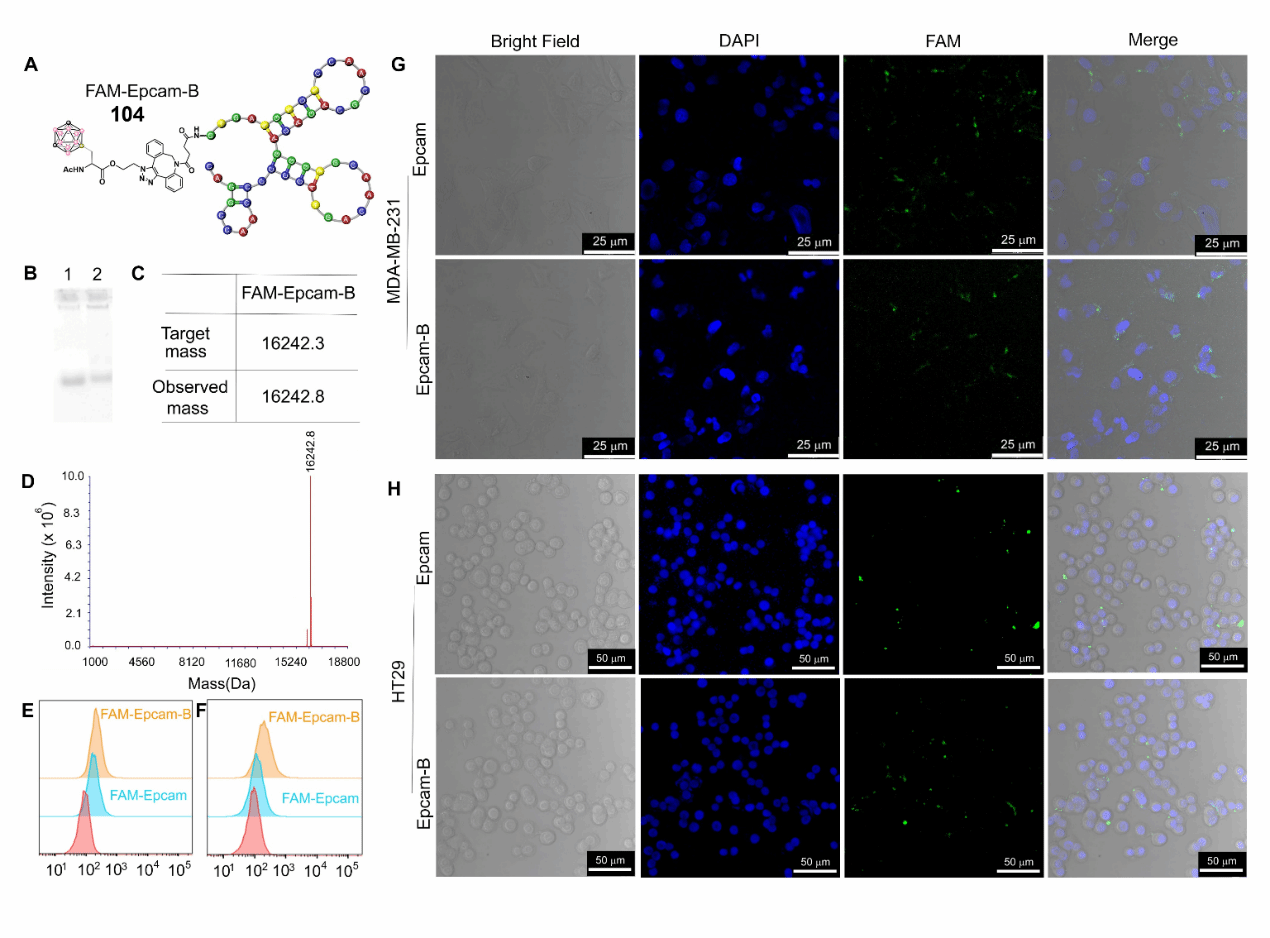
图7. 药物递送实验
基于实验数据和已有文献,我们提出了一个可能如图8所示的光催化反应机理。在紫光LED照射下,光催化剂[IrⅢ]吸收光子,跃迁到其激发态[IrⅢ]*。在碱的存在下,硼功能化的碳硼烷羧酸13a去质子化得到相应的碳硼烷羧酸根阴离子A,该阴离子通过单电子转移(SET)过程被[IrⅢ]*单电子氧化,生成碳硼烷自由基B和[IrⅡ],并伴随着CO₂的释放。然后碳硼自由基B参与缺电子的脱氢丙氨酸(Dha)残基14a的Giese型加成,形成自由基中间体C。随后C被[IrⅡ]单电子还原产生碳负离子中间体D,D被质子化得到最终产物16。
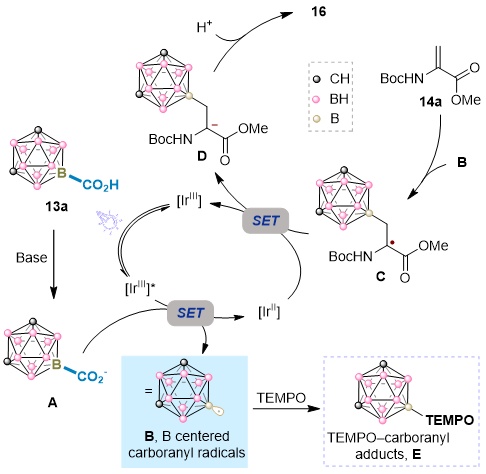
图8. 可能的反应机理
综上,本研究发展了一种新颖的光催化脱羧B–C交叉偶联反应,实现了硼功能化碳硼烷羧酸与含脱氢丙氨酸(Dha)多肽之间的位点选择性偶联。该反应通过硼顶点碳硼烷自由基途径进行,能够在多肽后期修饰中高效、高选择性地引入富硼碳硼烷单元,产率良好至优异,底物适用性广且官能团兼容性出色。该研究首次合成了光学纯的B-顶点取代碳硼烷丙氨酸(B-Cbz),并借助固相合成将其顺利嵌入复杂多肽序列。此外,所获得的碳硼烷衍生物可成功用于DNA兼容点击反应及适配体生物偶联。该研究不仅建立了碳硼烷功能化肽与适配体的模块化合成平台,还首次实现了核酸递送策略与硼簇治疗的结合,为新一代用于BNCT和精准肿瘤学的靶向硼递送剂开发开辟了新路径。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c10308
团队长期欢迎对科研充满热情的博士后、博士及硕士同学加入,共同探索未知、追求卓越。欢迎感兴趣的同学随时咨询!
课题组网站:https://fengzhu.sjtu.edu.cn;联系方式:fzchem@sjtu.edu.cn。








