


近日,上海交通大学变革性分子前沿科学中心朱峰/杨波团队联合农业与生物学院郑凌君团队、加泰罗尼亚化学研究所李英姿博士以及南京师范大学食品与制药工程学院张幸教授团队取得重要研究进展。相关研究成果“Stereoselective C(sp3)-Si/Ge bond formation via nickel-catalyzed decarboxylative couplings”为题发表在发表于国际著名期刊Chem上。
碳水化合物作为最基本的生物分子,其结构多样性在药物研发等多个领域具有重要应用价值。通过修饰糖苷键构建糖模拟物,不仅可提升其化学稳定性,还能改善类药性质。已有研究表明,糖苷键的种类及其构型对糖模拟物在体内的稳定性和与靶标蛋白的结合能力具有直接影响。由于天然O-糖苷易于水解,近年来人们致力于以碳、氮、硫、硒等元素取代糖苷中的氧原子,从而构建更稳定的新型糖苷结构,成为研究的热点方向。其中,C-糖苷因其优异的代谢稳定性,在抗癌和抗疟药物开发中展现出重要潜力。例如,C-糖苷化的KRN7000衍生物表现出比母体分子高出近1000倍的活性(图1b左)。相比之下,第14族元素的硅/锗糖苷作为新型糖模拟物的研究仍属空白。硅和锗因其独特的物理化学性质,在分子修饰中备受关注。它们可替代生物分子中的碳原子,进而优化分子的生物学性能。例如,硅/锗环戊醇类似物(11/12)展现出显著优于碳基分子10的受体亲和力(图1b右)。尽管类金属效应研究不断深入,但硅/锗在碳水化合物中的应用尚未得到系统开发。多羟基结构为引入疏水性硅/锗基团提供了理想平台,有望突破传统碳糖苷的膜渗透性与体内性能局限。然而,Ge/Si-糖苷的合成仍面临三个关键挑战:其一,较大的原子半径导致显著的空间位阻;其二,较长的键长削弱立体识别能力;其三,低旋转能垒易引发异头构型的不稳定。目前已有方法多依赖于低温条件下的锂化还原(如13)或硅基迁移策略,但普遍存在β-消除副反应,且Ge-糖苷及非异头位点的修饰尚未报道。此外,高效的催化合成路径仍未建立(图1c右)。
上海交通大学变革性分子前沿科学中心朱峰课题组长期致力于糖类化学合成与蛋白质化学修饰研究,围绕糖基/肽基金属试剂参与的过渡金属催化交叉偶联反应开展特色探索,发展了一系列高效、精准的糖类、多肽及蛋白质合成方法(J. Am. Chem. Soc. 2025, accepted; Angew. Chem. Int. Ed. 2025, doi:10.1002/anie.202511045; Angew. Chem. Int. Ed. 2025, 64, e202504504; Nat. Commun. 2024, 15, 5228; Angew. Chem. Int. Ed. 2023, 62, e202314832; Angew. Chem. Int. Ed. 2022, 61, e202207153; Chem Catal. 2021, 1, 870 等)。上海交通大学变革性分子前沿科学中心朱峰/杨波团队联合农业与生物学院郑凌君团队、加泰罗尼亚化学研究所李英姿博士以及南京师范大学食品与制药工程学院张幸教授团队·,创新性地开发了镍催化策略:通过糖基NHPI酯(22)与锗锌/硅锌试剂(24/25)的立体选择性偶联,首次实现Ge/Si-糖苷的模块化催化合成(图1e)。此外,该方法成功构建了传统方法难以获得的手性硅/锗基1,2-氨基醇与二醇结构。机制研究表明,该反应通过Ni(0)介导的单电子转移(SET)激活NHPI酯,均裂N–O键并脱羧生成关键自由基,揭示了一条创新性的反应路径。此策略不仅填补了锗糖苷合成领域的空白,也加深了对氧化还原活性酯在过渡金属催化中的活化机制的理解。此外,初步生物学评估显示,所构建的新型Ge/Si-糖苷具有新颖的生物活性:不仅对宫颈癌和乳腺癌细胞具有显著抗肿瘤效应,在秀丽隐杆线虫模型中亦展现出抑瘤、调脂及抗衰老等生理活性,凸显其在生物医药领域的广阔应用前景。

图1. Ge/Si-糖苷合成的研究现状
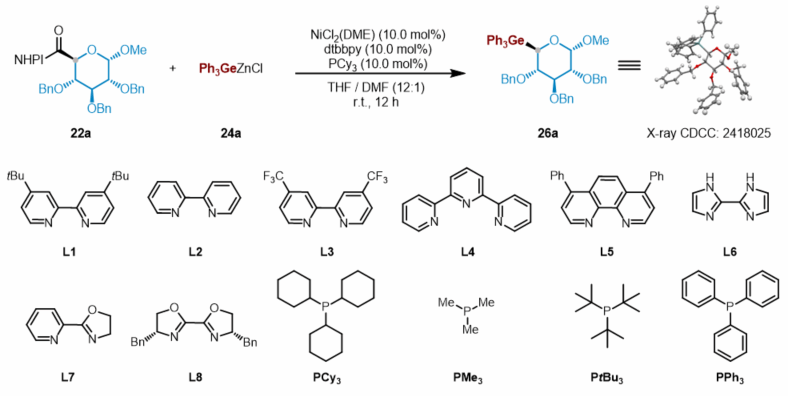
作者首先对反应条件进行了系统优化。研究表明,在10.0 mol% NiCl₂(DME)催化剂、dtbbpy与PCy₃双配体体系下,以THF/DMF(12:1)为溶剂,在氮气氛围中室温反应12小时,三苯基锗锌试剂与葡萄糖基NHPI酯可高效偶联,生成目标Ge-糖苷,分离产率达85%。该反应在非经典C5位实现了绝对的α-立体选择性,产物的构型通过X射线单晶衍射进一步确证。
| Entry | Deviation from standard conditions | Yield (%) |
| 1 | none | 85 |
| 2 | w/o NiCl2(DME) | 0 |
| 3 | w/o dtbbpy L1 | 9 |
| 4 | w/o Cy3P | 47 |
| 5 | NiCl2(dtbbpy) instead of NiCl2(DME) and dtbbpy | 85 |
| 6 | Ni(PCy3)2Cl2 instead of NiCl2(DME) and PCy3 | 86 |
| 7 | CuTc, PdCl2 or CrCl3 instead of NiCl2(DME) | 0 |
| 8 | CoBr2(DME) or FeBr2 instead of NiCl2(DME) | trace |
| 9 | L2, L3, L4 instead of L1 | 82, 66, trace |
| 10 | L5, L6, L7, L8 instead of L1 | 61, 49, 64, 26 |
| 11 | PMe3, PtBu3, PPh3, instead of PCy3 | 31, 68, 56 |
| 12 | Ph3GeZnOPiv instead of Ph3GeZnCl Deviation from entry 5 condition | 58 |
| 13 | THF instead of THF/DMF | 71 |
| 14 | DMAc instead of DMF | 74 |
| 15 | NMP instead of DMF | 82 |
| 16 | 22a : 24a = 1 : 2 | 58 |
| 17 | 22a : 24a = 1 : 1 | 70 |
表1. 催化条件优化
作者进一步考察了糖基NHPI酯与锗基锌试剂在镍催化脱羧偶联反应中构建立体选择性Ge-糖苷的底物适用性(图2)。结果表明,该反应对多种不同糖型及保护基团的糖基NHPI酯均具有良好兼容性,能够高效生成相应的Ge-糖苷产物。此外,其他类型的锗锌试剂,如三对甲基苯基锗锌、甲基二苯基锗锌及二甲基(苯基)锗锌试剂,也均可与葡萄糖基NHPI酯顺利反应,生成相应的目标产物,进一步展现了该方法的通用性与稳健性。
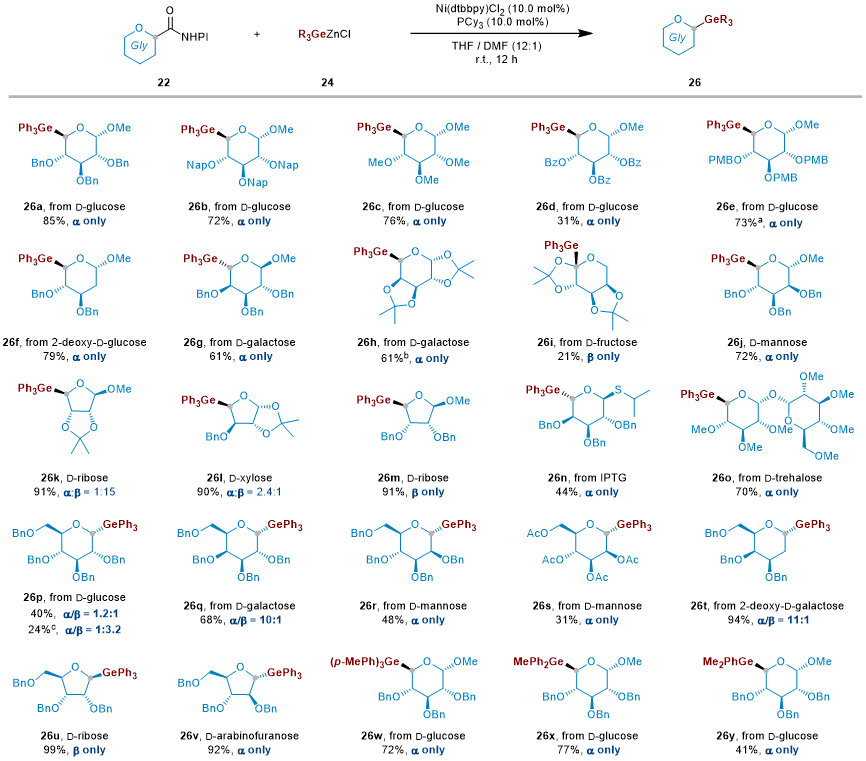
图2. 镍催化立体选择性合成锗糖苷
由于锗与硅在反应性及物理化学性质方面存在显著差异,许多为硅化学设计的合成策略难以直接应用于锗化学,导致锗相关方法的发展相对滞后。因此,开发一种同时适用于硅与锗的通用合成方法,仍是一个重要的挑战。基于此前在Ge-糖苷合成中的成功经验,作者进一步探索了该镍催化NHPI酯与有机硅锌试剂偶联反应在立体选择性合成Si-糖苷中的应用潜力。令人欣喜的是,该策略同样适用于多种经典和非经典Si-糖苷的构建,展现出良好的普适性(图3)。然而,与锗糖苷化反应相比,硅糖苷化反应的产率略低,可能是由于还原性不同以及β-消除路径的竞争增强,导致副产物的生成增加。
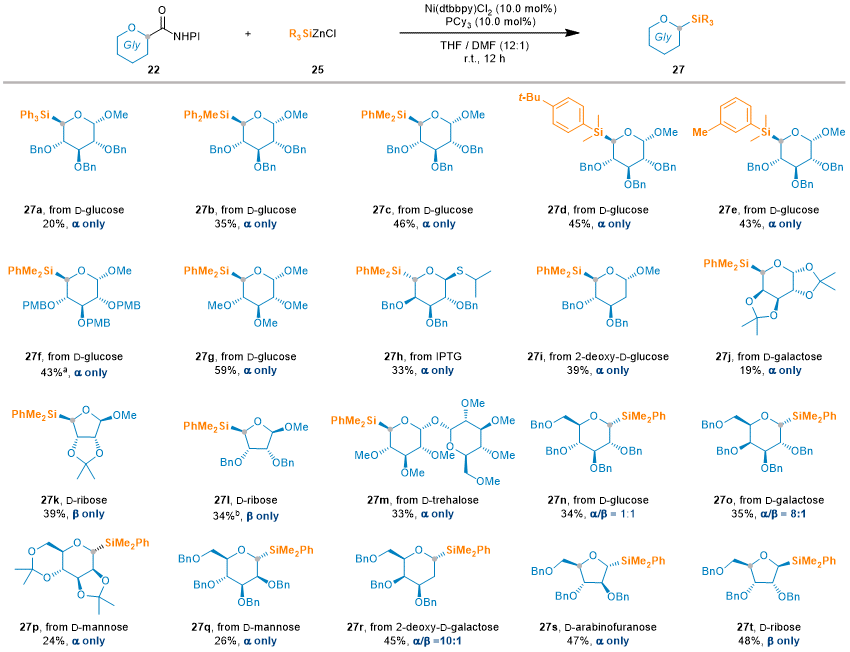
图3. 镍催化立体选择性合成硅糖苷
氨基醇及其衍生物是众多药物活性天然产物、医药活性成分及农用化学品中的重要结构单元。尤其是α-和β-位有机硅/有机锗氨基化合物,广泛存在于药物、氨基酸及香料分子中,其立体选择性合成因而成为研究热点。基于此,作者进一步探讨了镍催化氧化还原活性酯与锗锌/硅锌试剂的交叉偶联反应(图4),在类金属取代氨基醇对映选择性合成中的应用潜力。
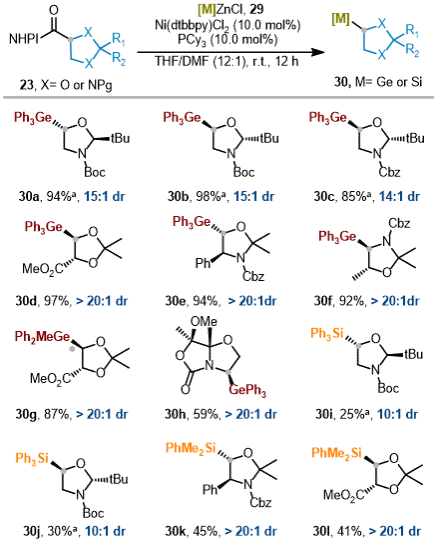
图4. 立体选择性合成手性硅/锗基1,2-氨基醇和二醇
为展示所开发镍催化高立体选择性Ge-及Si-糖苷化反应的可扩展性,作者开展了系列放大反应及脱保护实验,且该反应在空气环境下亦能顺利进行(图5)。值得注意的是,机理研究结合DFT计算揭示了新颖的Ni(0)/Ni(I)/Ni(II)催化循环,显著深化了对镍催化NHPI酯与有机金属试剂偶联反应机制的理解(图6)。
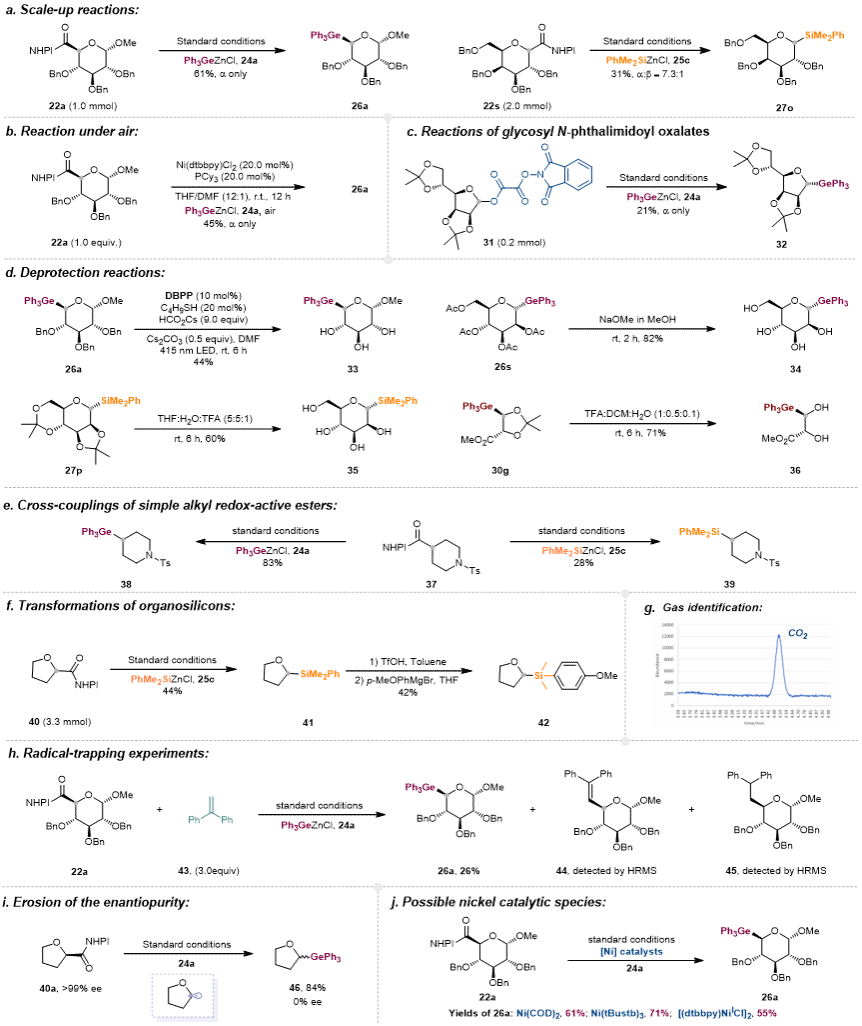
图5. 合成应用与机理研究
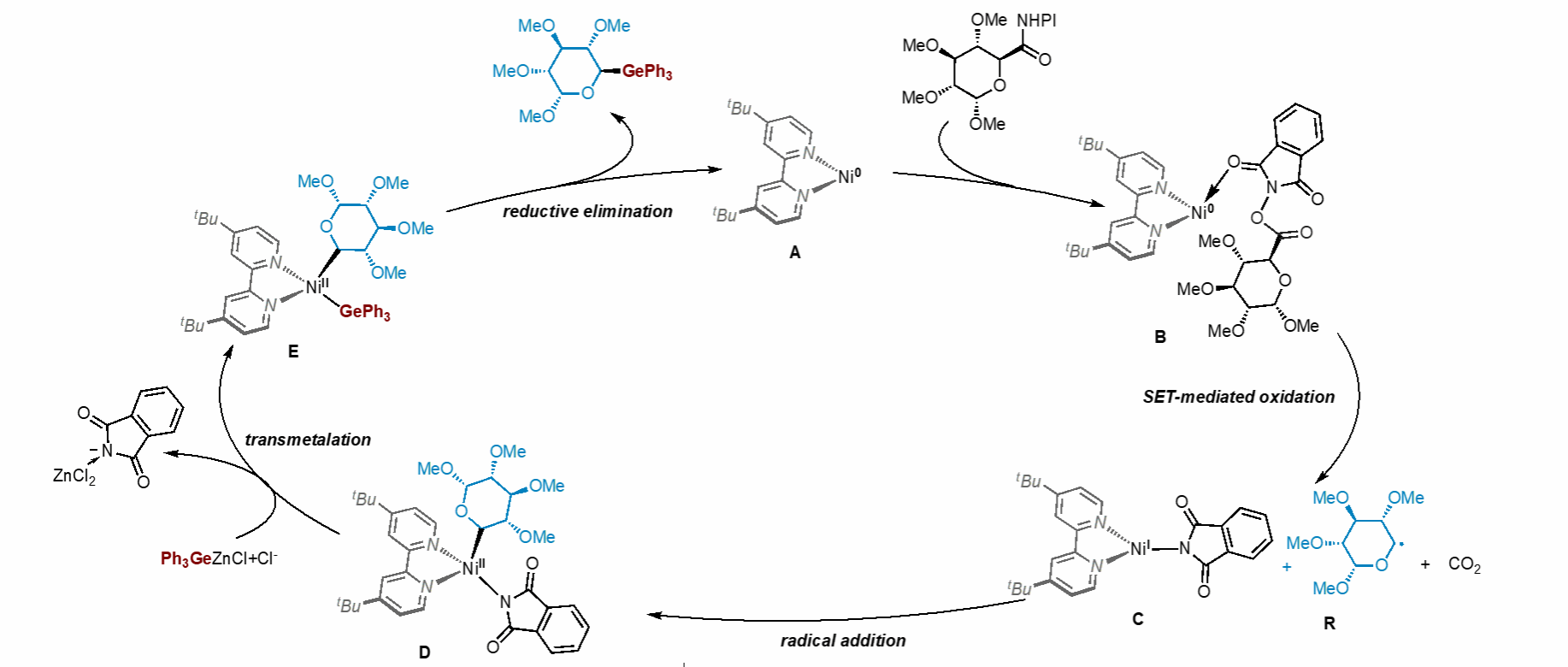
图6. 可能的反应机理
Ge/Si-糖苷的开发可能为糖修饰药物分子的设计提供新的研究方向,具有赋予其增强或全新的生物活性的潜力。在生物活性评估之前,作者系统考察了这些新型Si/Ge-糖苷的化学和酶解稳定性。鉴于甘露糖在免疫应答及病原体识别等糖介导过程中的关键作用,作者选取甘露糖作为母核开展后续生物学评价。为此,合成了代表性甘露糖类似物Man-OPh 47和Man-CH₂Ph 48作为对照,与Man-GePh₃ 34和Man-SiPhMe₂ 35共同进行稳定性测试。在37℃条件下,34、47和48在强酸(1 M HCl)与强碱(pH=13 NaOH)环境中均展现出优异稳定性,96小时内保持结构完整无明显降解。相比之下,硅糖苷35在酸碱条件下均出现显著降解,仅在碱性环境中表现出一定稳定性。在更严苛条件下(90℃ 1 M HCl),碳糖苷48如预期保持稳定,硅糖苷与氧糖苷则在1小时内完全水解,锗糖苷34表现出更强耐受性,需2小时方才完全水解。酶稳定性测试显示,再暴露于外切α-1,2-甘露糖苷酶时,碳糖苷48、锗糖苷34与硅糖苷35均能耐受酶解,唯有天然氧糖苷38被酶水解(图7)。
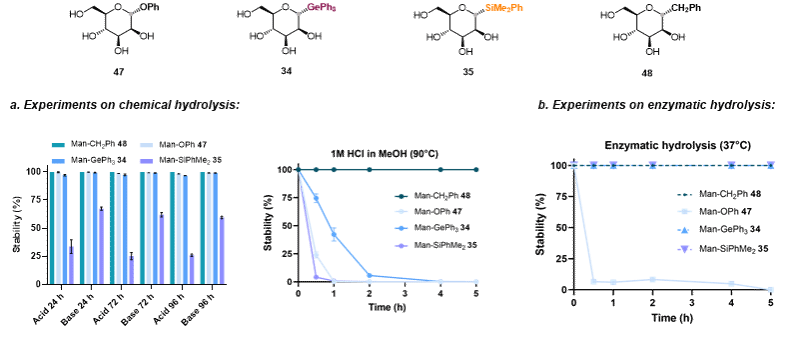
图7. 水解稳定性研究
为评估糖苷类似物的潜在抗肿瘤活性,作者测试了Man-OPh 47、Man-CH₂Ph 48和Man-SiPhMe₂ 35对宫颈癌细胞系HeLa和乳腺癌细胞系MCF-7的作用。结果显示,以上类似物均未表现出显著的抗肿瘤活性。与之形成鲜明对比的是,Man-GePh₃ 34对两种癌细胞均展现出显著的抗增殖效果。进一步研究表明,Man-GePh₃在低至100 μM浓度下即可对MCF-7细胞产生明显抑制作用(图8)。
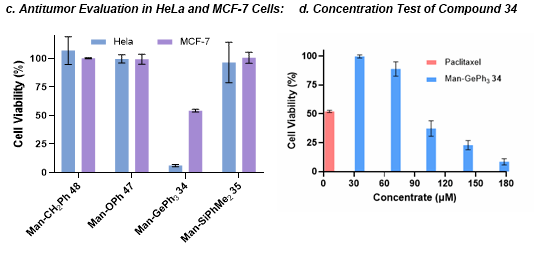
图8. 抗肿瘤活性研究
此外,通过线虫模型进行多维药效评价(图9),作者发现:在glp-1突变株的生殖系肿瘤模型中,Ge-糖苷显著降低大型肿瘤的发生率,而O-糖苷和Si-糖苷未表现出显效;Si-糖苷有效抑制由高脂饮食(蛋黄喂养)诱导的脂质沉积;Ge-糖苷显著提升UVB(280–320 nm)照射下线虫的存活时间。值得注意的是,O/Si/Ge-糖苷均未对线虫的产卵能力、生殖周期及子代发育产生影响,表明其无明显生殖毒性。
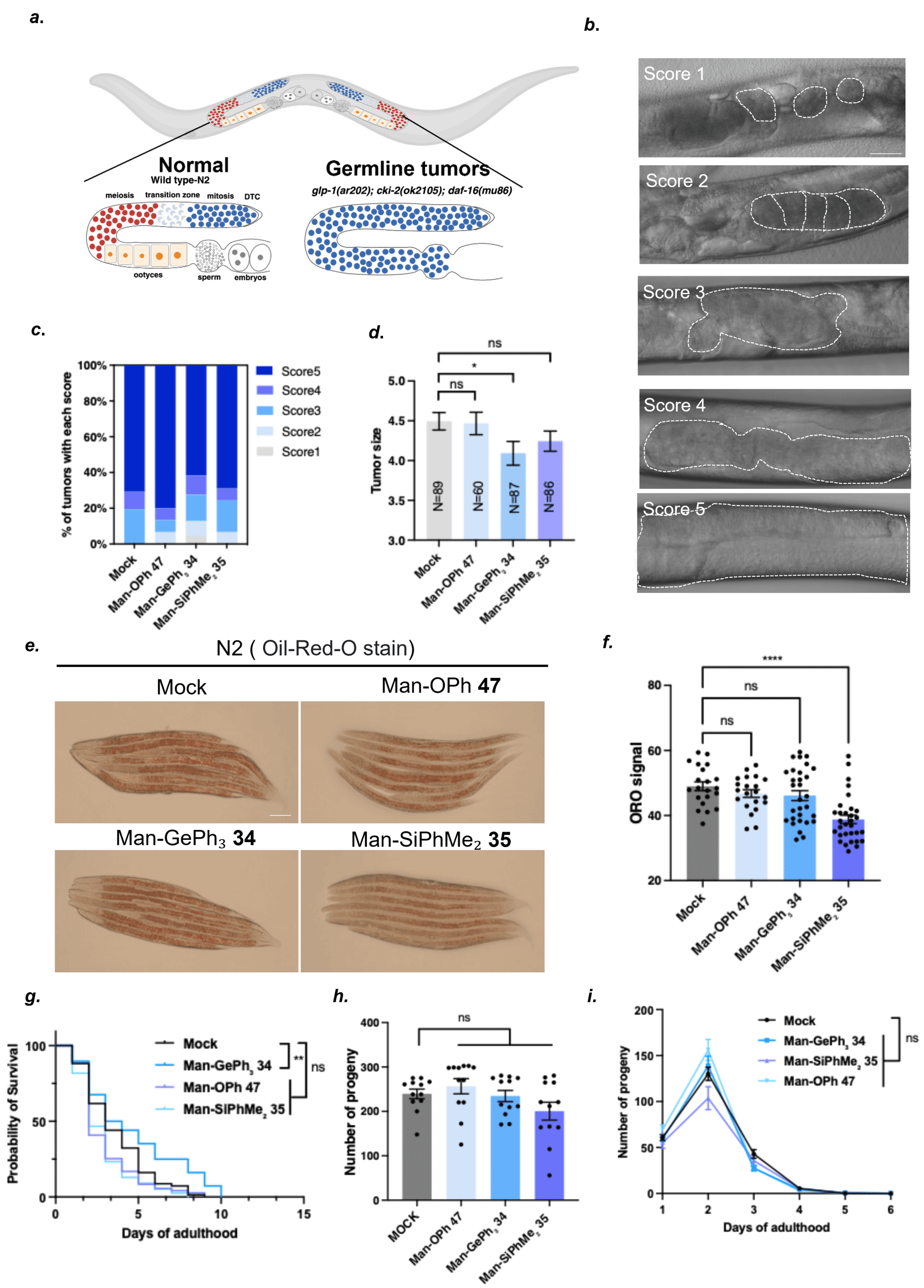
图9. 线虫活性研究
综上,作者首次建立了一种高立体选择性的糖基NHPI酯与硅锌/锗锌试剂脱羧交叉偶联反应,实现了C(sp3)-Si和C(sp3)-Ge键的高效立体选择性构建。该策略不仅开发了Si-/Ge-糖苷合成的首个催化方法,填补了Ge-糖苷合成的研究空白,还展现出优异的通用性和实用性,具备应用于含Si/Ge结构单元药物设计及立体选择性合成的潜力。机理研究结合DFT计算揭示了新颖的Ni(0)/Ni(I)/Ni(II)催化循环机制,阐明了镍催化自由基脱羧过程中NHPI酯的独特活化路径——Ni(0)促进N–O键断裂。该机制革新了对镍催化NHPI酯与有机金属试剂偶联反应机理的理解。此外,初步生物学评价显示,新型Ge-/Si-糖苷表现出显著的生物活性:不仅对宫颈癌和乳腺癌细胞具备抗增殖作用,在线虫模型中亦展现出抗肿瘤、抗肥胖及抗衰老等多重生理功能,显示出广阔的生物医学应用前景。
上海交大学变革性分子前沿科学中心朱峰副教授、杨波助理研究员、农业与生物学院郑凌君副教授、加泰罗尼亚化学研究所李英姿博士、南京师范大学食品与制药工程学院张幸教授为共同通讯作者,上海交通大学与南京师范大学联合培养硕士生王鑫和陶强为论文共同第一作者,上海交通大学为第一工作单位。同时感谢上海交通大学赵诗音、尤龙浓、曾耀勇和南京师范大学张俊杰、乔梦、刘思锐对项目研究做出了重要贡献。
团队长期欢迎对科研充满热情的博士后、博士及硕士同学加入,共同探索未知、追求卓越。欢迎感兴趣的同学随时咨询!
文章链接:https://www.cell.com/chem/abstract/S2451-9294(25)00304-3
课题组网站:https://fengzhu.sjtu.edu.cn;联系方式:fzchem@sjtu.edu.cn。








