

研究背景
糖类化合物是生命体系中不可或缺的重要分子。它们不仅是生物体的主要能量来源和结构单元,还在各种生理过程中发挥着不可替代的作用。在众多糖类化合物中,C-糖苷尤为引人注目。相比于O-糖苷和N-糖苷,C-糖苷展现出更优异的水解和代谢稳定性,因此在生命科学研究和药物开发中具有突出的科学意义和应用价值。尤其是带有芳基、烯基等碳取代基的1-C-糖苷,广泛存在于天然产物和药物分子中,应用和研究价值不容忽视(图1a)。例如,抗糖尿病药物达格列净 (1)、Trioxadecalin 衍生的液晶化合物 (2)、以及具有抗淋巴细胞白血病活性的天然产物 (+)-Aspergillides C (3)。除了1-C-糖苷,糖环非异头碳位置上的C-支链糖类化合物同样具有重要研究价值,它们也是诸多天然分子和生物活性化合物的核心结构单元。例如,高附加值的稀有糖衍生物3-苯基-D-阿洛糖(4)以及抗真菌的天然产物 (-)-柳杉树脂酚(5)。然而,糖类化合物的复杂结构多样性和多位点修饰特征,既为为药物设计提供了广阔空间,同时也显著增加了合成和修饰的难度。尽管在1-C-糖苷的合成已取得突破性进展,但C-支链糖类化合物的立体选择性合成,尤其是具有重要生物活性的 3-C-糖苷,始终是糖合成化学面临的重大挑战(图1b)。因此,发展高效、精准的糖化学合成策略,实现 C-支链糖类化合物的可控构建,不仅具有重要的学术意义,也蕴含着巨大的应用潜力。
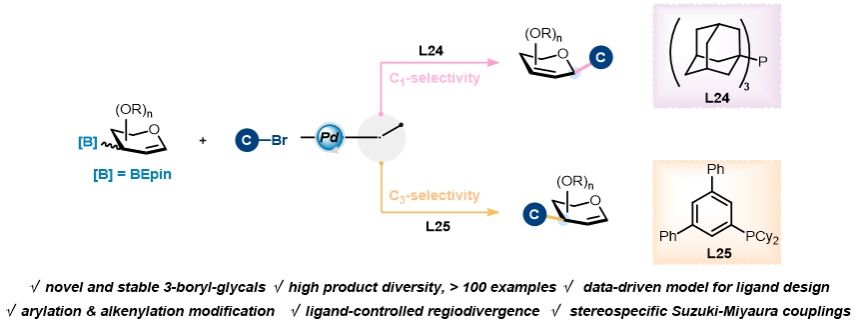
近日,上海交通大学变革性分子前沿科学中心朱峰课题组在糖化学合成研究中取得重要进展。基于前期在糖烯基硼试剂的研究工作(Nat. Commun. 2024, 15, 5228),团队设计并合成一系列以1,1,2,2-四乙基乙二醇保护的3-硼酸酯糖烯作为稳定且构型稳定的糖基供体,有效解决了糖类合成中反应活性与稳定性难以兼顾的长期挑战;利用钯催化与不同配体的协同作用,通过配体调控实现了C1与C3位点的区域选择性控制;结合DFT计算和多元回归分析,进一步建立了配体结构与区域选择性的定量关系模型,为配体的理性设计提供了理论依据。该糖基Suzuki–Miyaura交叉偶联策略(GSMC)突破了传统糖基化反应的区域选择性限制,首次实现了从同一前体出发,通过配体选择可控地合成3-C-糖烯和2,3-不饱和C-糖苷两类重要产物。值得强调的是,所得产物中的不饱和双键可进一步进行多样化官能团修饰,为生物活性分子类似物的构建以及含糖材料的合成开辟了新的可能,展现出在药物发现和材料科学领域的广阔应用前景。该研究成果近期发表于《德国应化》(Angew Chem Int Ed. DOI:10.1002/anie.202511045),上海交通大学变革性分子前沿科学中心朱峰副教授、杨波助理研究员以及加泰罗尼亚化学研究所的李英姿博士为共同通讯作者,变革性分子前沿科学中心毕业博士生陈安荣与周正红为论文的共同第一作者。
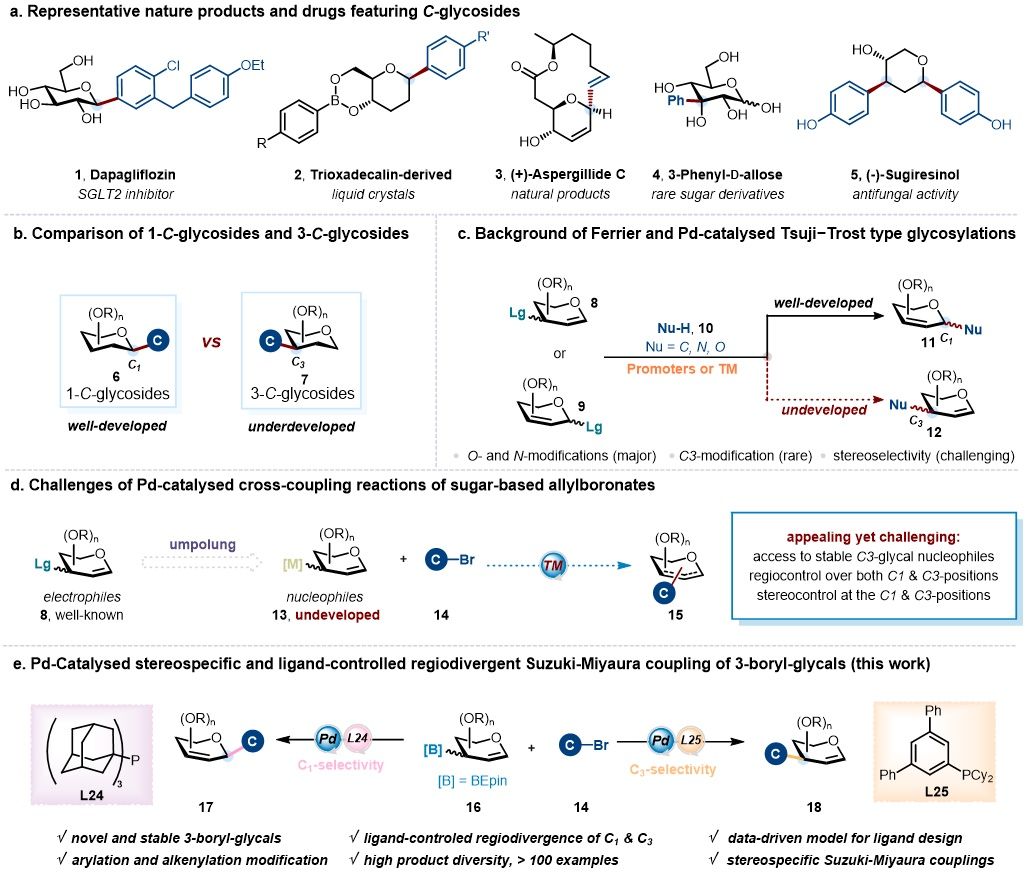
图1. 研究背景 (图片来源:Angew Chem)
研究内容
在成功制备一系列稳定的3-糖基烯丙基硼试剂后,作者进一步优化了催化体系,并系统考察了不同膦配体对于反应区域选择性和立体选择性的影响(图2)。研究结果表明,以二甲基叔丁硅基(TBS) 保护的D-葡萄糖3-烯丙基硼 (16a)和4-溴苯甲酸甲酯作为模型底物时,当使用 (2'-甲氨基-1,1'-联苯-2-基)甲磺酰钯(II)二聚体 (Pd-G4 dimer) 作为钯催化剂前体,大位阻、富电子的三金刚烷膦为配体,并以磷酸钾为碱、四氢呋喃为溶剂,
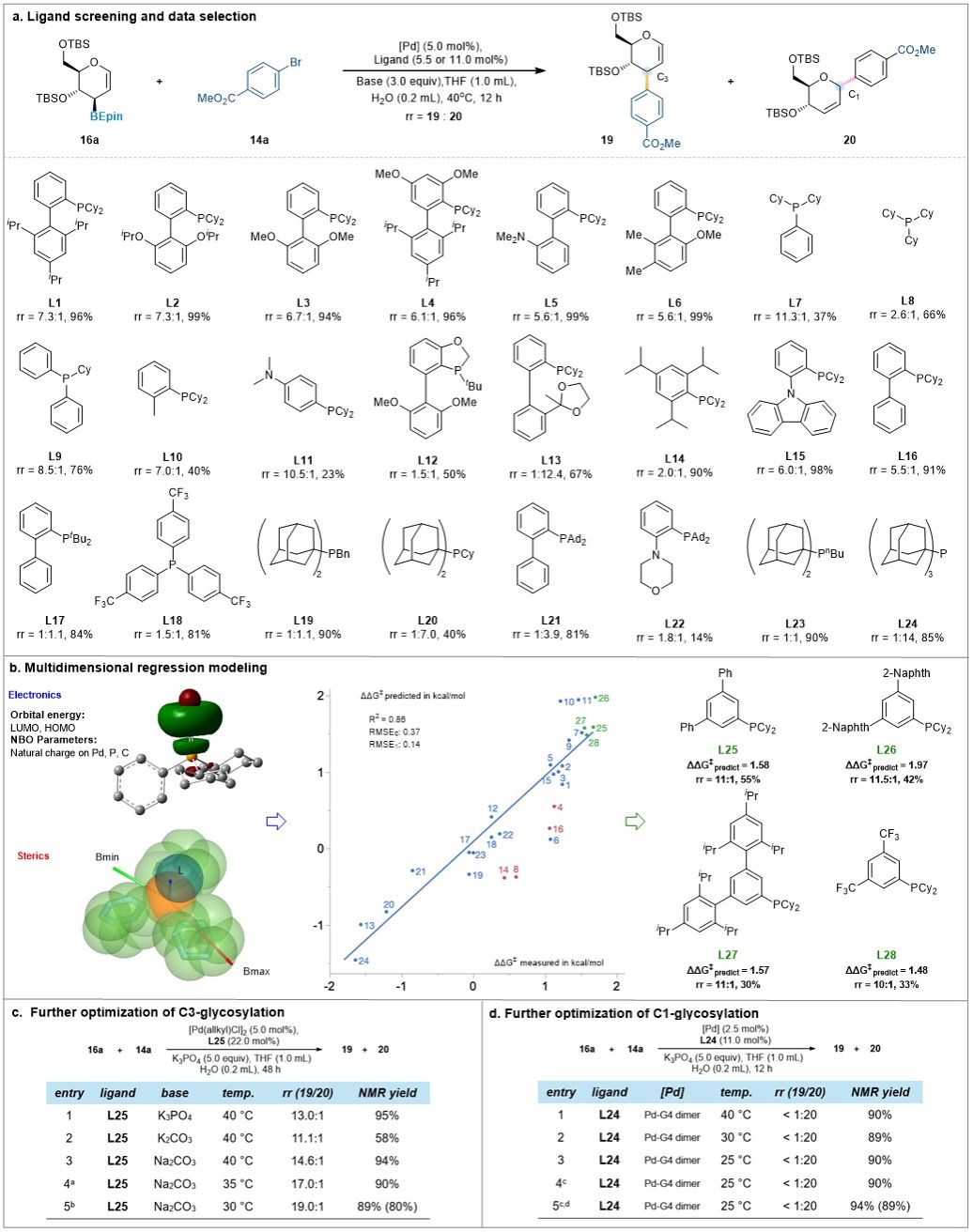
图2. 条件筛选 (图片来源:Angew Chem)
在室温下反应12小时,即可高效得到目标化合物 20,区域选择性优于20:1,分离收率达89%。相较之下,当使用烯丙基氯化钯作为钯催化剂前体,3,5-二苯基取代苯基二环己基膦为配体,并以碳酸钠为碱、
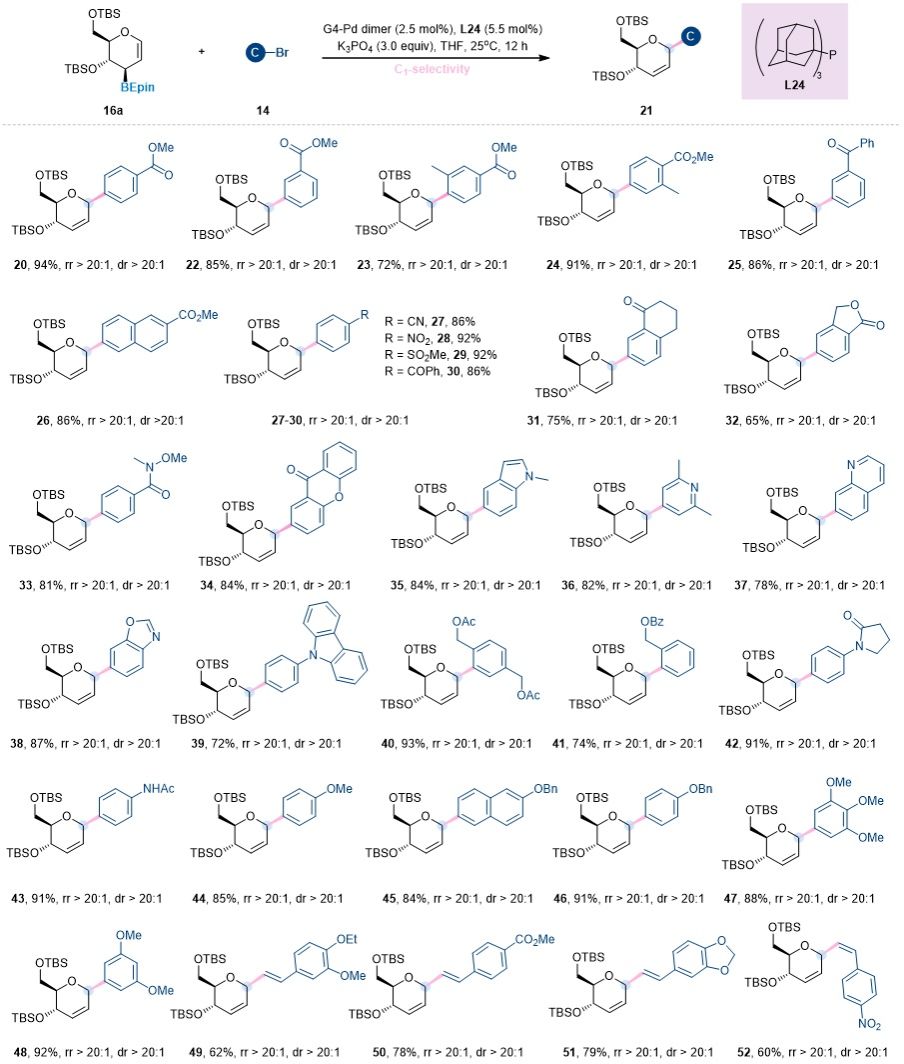
图3. 1-C-糖苷化反应的亲电试剂底物拓展 (图片来源:Angew Chem)
四氢呋喃和水作为混合溶剂,在30°C下反应5天,既可获得目标化合物19,区域选择性为19:1,分离收率为80%。
在确定了两组最优的反应条件后,作者首先系统考察了钯催化糖环1位选择性糖基Suzuki偶联反应对不同取代亲电试剂的适用范围。如图3所示,该反应表现出非常广泛的底物普适性。无论是带有缺电子取代基(如酯基、酮基、腈基、硝基、砜基和酰胺基),还是富电子取代基(如烷氧基、烷基和胺基)的芳基溴代物,都能顺利发生偶联,以优异的区域选择性生成2,3-不饱和的1-C-(杂)芳基糖苷产物。此外,该反应对杂芳环底物亦具有良好的耐受性,能够高效转化为相应的1-C-糖苷产物,并保持优异的区域选择性。更为重要的是,该策略成功拓展至溴代乙烯基化合物的偶联,合成得到1-C-乙烯基糖苷化合物,且具有立体专一性的Z/E 构型。
为了进一步拓展糖环1位选择性糖苷化的适用范围和多功能性,作者考察了多种市售生物活性分子、药物和多肽衍生的亲电试剂在糖基交叉偶联反应中的表现 (图4)。研究结果表明,这些复杂分子均能顺利实现糖基化修饰,并以高效的反应活性和优异的区域选择性得到目标产物。
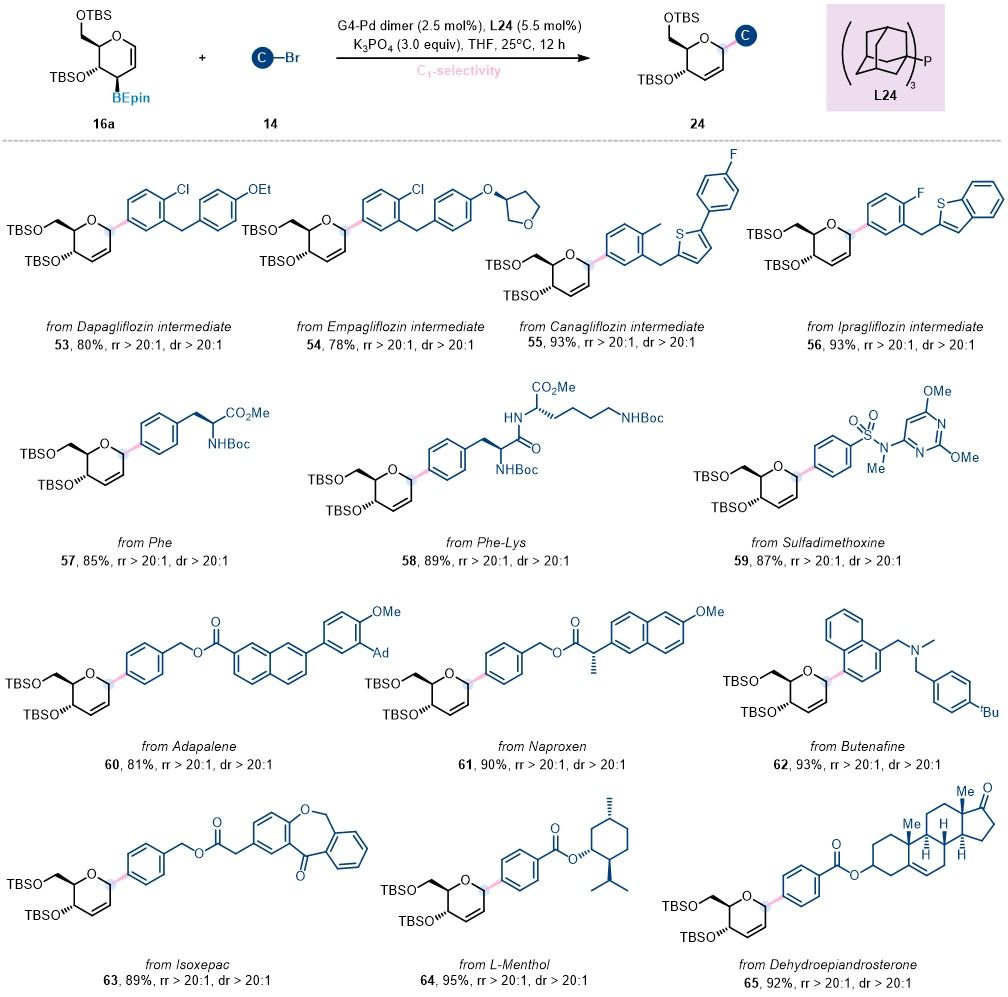
图4. 1-C-糖苷化反应的复杂亲电试剂底物拓展 (图片来源:Angew Chem)
随后,作者进一步考察了糖环1位选择性糖基交叉偶联反应对糖基底物的适用性。如图5所示,不同保护基修饰的3-糖烯丙基硼均能良好适应该反应条件,并以优异选择性高效转化为 2,3-不饱和的1-C-芳基糖苷化合物。此外,该策略在不同类型吡喃糖衍生物中也表现出良好的实用性。来源于常见吡喃糖的3-糖烯丙基硼,如D-半乳糖、6-脱氧-D-葡萄糖和L-葡萄糖,均能顺利进行交叉偶联反应,并以良好的收率得到相应的2,3-不饱和的1-C-芳基糖苷。更为重要的是,通过X-ray单晶衍射分析对化合物70的结构进行了表征,明确证实了产物C1位的β-选择性以及糖环2,3-位双键的存在。
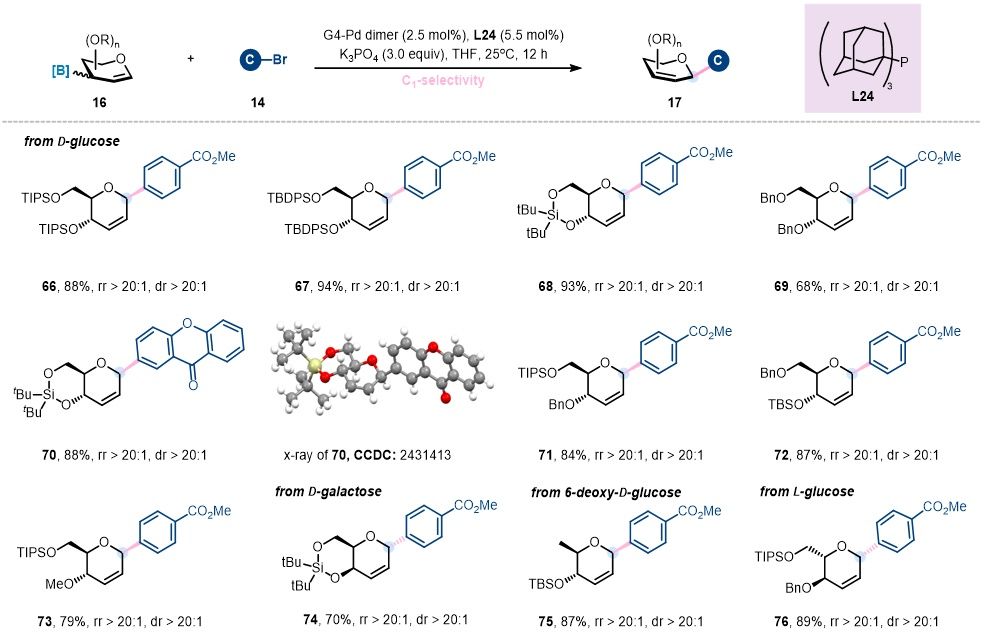
图5. 1-C-糖苷化反应的糖基底物拓展 (图片来源:Angew Chem)
随后,作者为进一步拓展糖环3位选择性糖基交叉偶联反应的适用范围,系统考察了不同类型的亲电试剂在该反应中的表现。如图6所示,该反应对多种芳基及烯基卤化物均表现出良好的耐受性,适用于带有给电子或吸电子取代基的芳基亲电试剂。值得注意的是,该策略不仅适用于芳基亲电试剂,苯乙烯基溴化物亦能顺利参与交叉偶联反应,并以中等收率和优秀区域选择性成功合成相应的糖环3位烯基化产物。
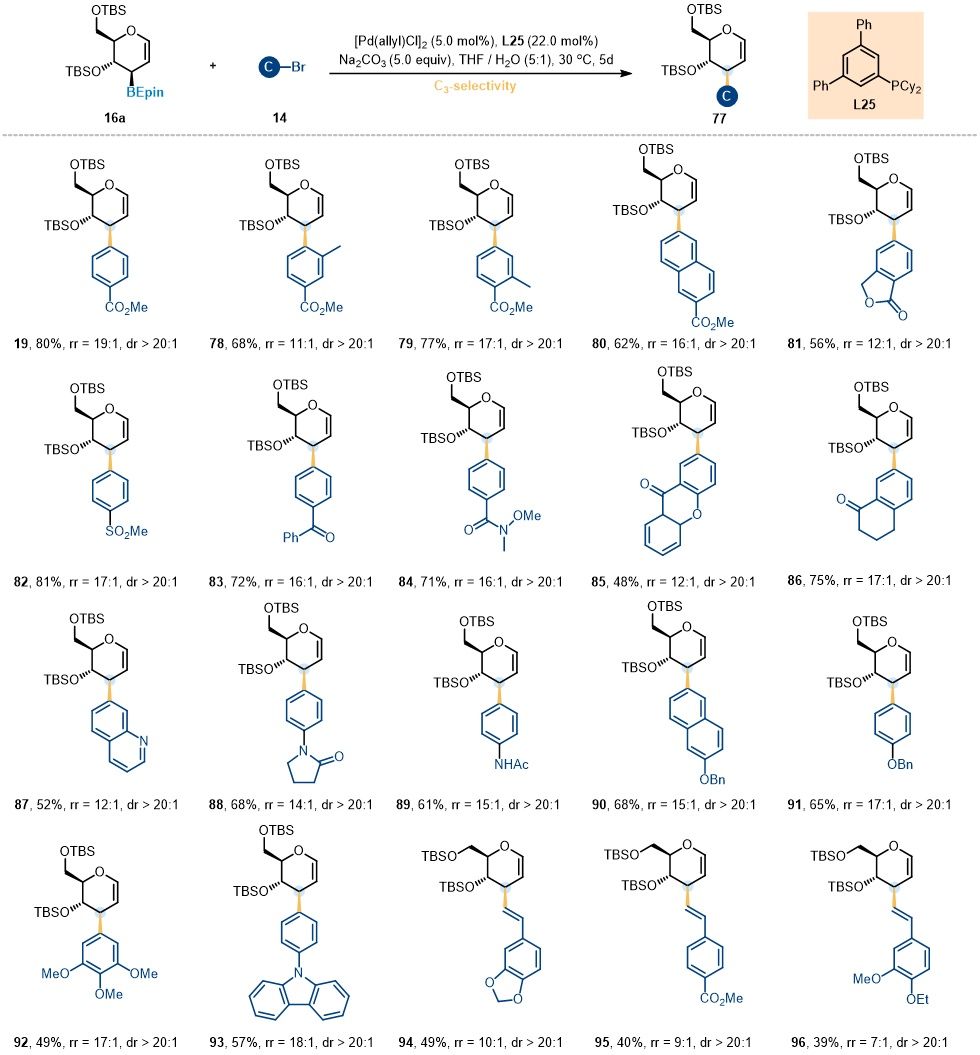
图6. 3-C-糖苷化反应的亲电试剂底物拓展 (图片来源:Angew Chem)
受上述结果的启发,作者进一步考察了含生物活性分子、药物分子以及氨基酸/多肽的亲电试剂在糖环3位选择性糖基交叉偶联反应中的适用性。如图7所示,先前用于糖环1位选择性糖苷化的复杂分子均能顺利参与反应,并以中等至良好收率得到相应的3-C-芳基糖烯产物,具有优异的立体选择性 (dr > 20:1) 和良好的区域选择性 (10:1至19:1)。
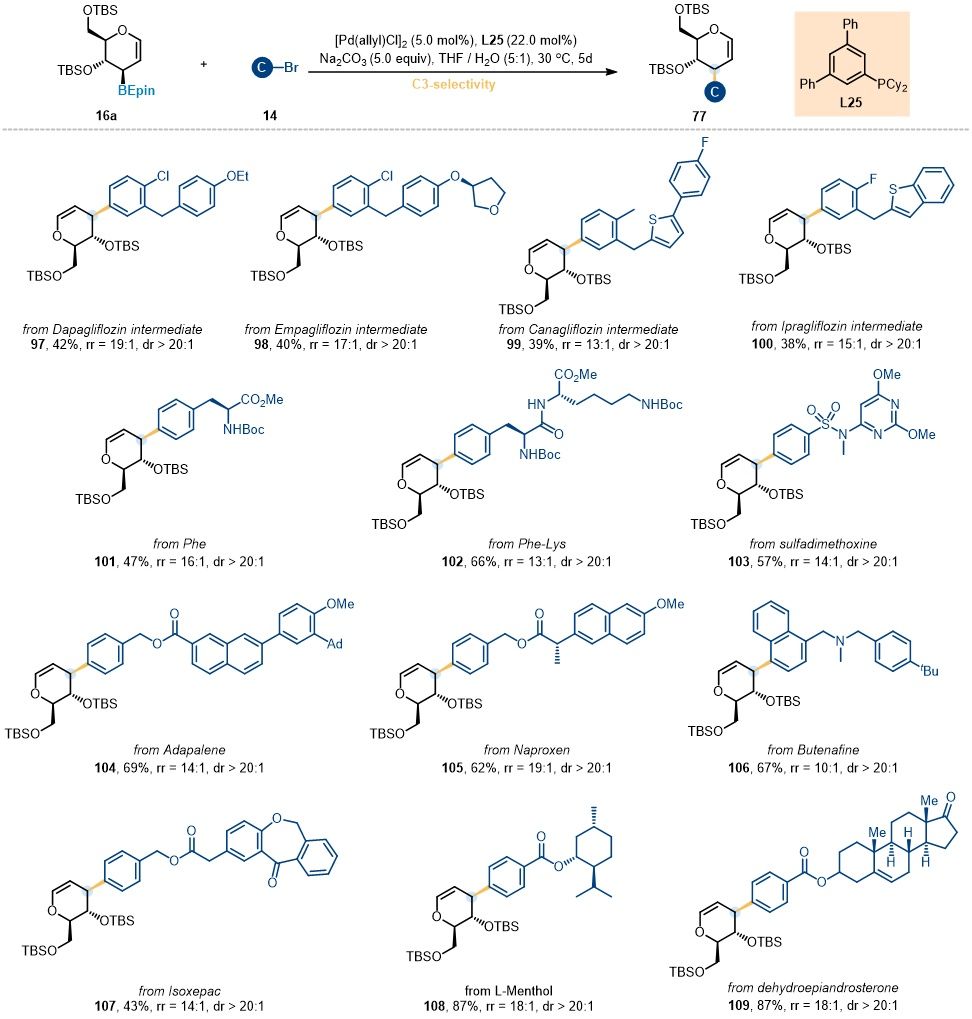
图7. 3-C-糖苷化反应的复杂亲电试剂底物拓展 (图片来源:Angew Chem)
最后,作者系统考察了不同糖底物在3-C-芳基糖烯合成中的适用性。如图8所示,不同保护基修饰的3-糖烯丙基硼均表现出良好的兼容性,能够以中等至较高收率及中等至优异选择性高效合成相应的3-C-芳基糖烯化合物。此外,不同类型的糖底物也表现出良好的反应性。然而,当采用D-半乳糖衍生的3-糖烯丙基硼作为底物时,尽管反应能够顺利进行,但其区域选择性相对低点。
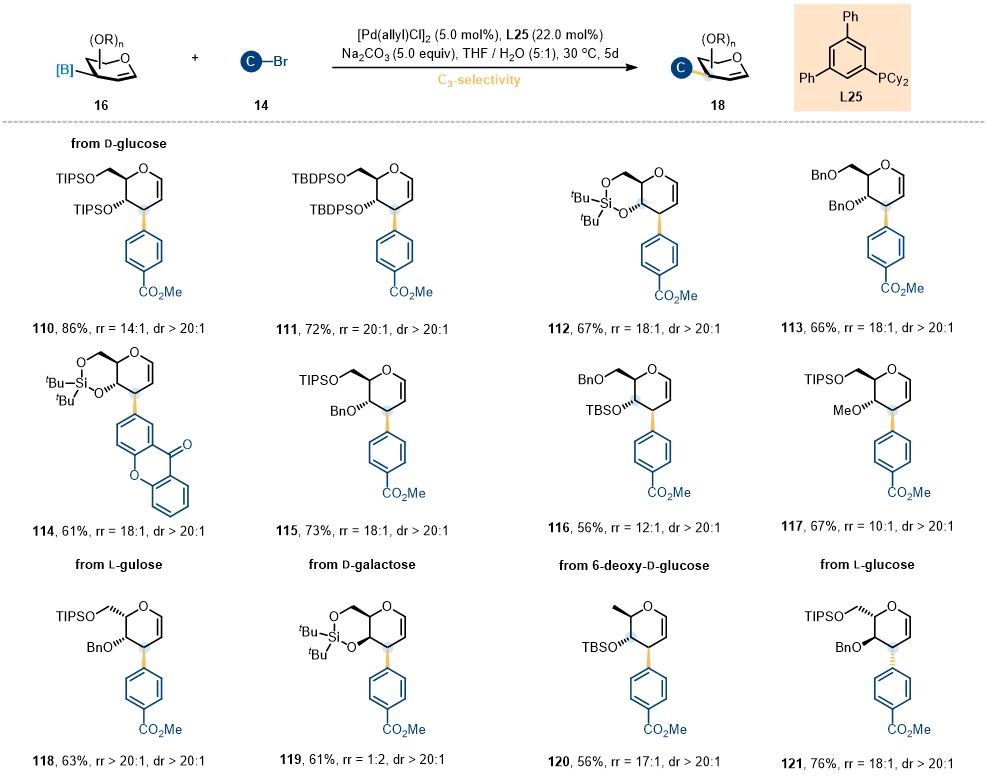
图8. 3-C-糖苷化反应的糖基底物拓展 (图片来源:Angew Chem)
为了全面展示该方法在合成上的实用性,作者对3-C-烯糖和2,3 -不饱和C-糖苷进行多样化衍生化实验(图9)。对产物19进行脱保护/甲酰基化得到化合物122,并通过X-ray确认了3-芳基糖的立体构型(图9a)。对达格列净前体53进行双羟基化/脱保护,获得异构体124/125(图9b);同时还原53烯烃得到类似物127。此外,3-芳基糖烯19经催化O-糖苷化得到二糖苷129(图9c);[4+2]环加成反应,得到潜在抗阿尔茨海默症的三并环化合物131(图9d)。合成新型硼酸酯133,通过区域选择性取代和Suzuki偶联得到双糖缀合物135(图9e),并将化合物44转化为含糖液晶分子137(图9f),进一步凸显了该方法的多功能性与应用潜力。
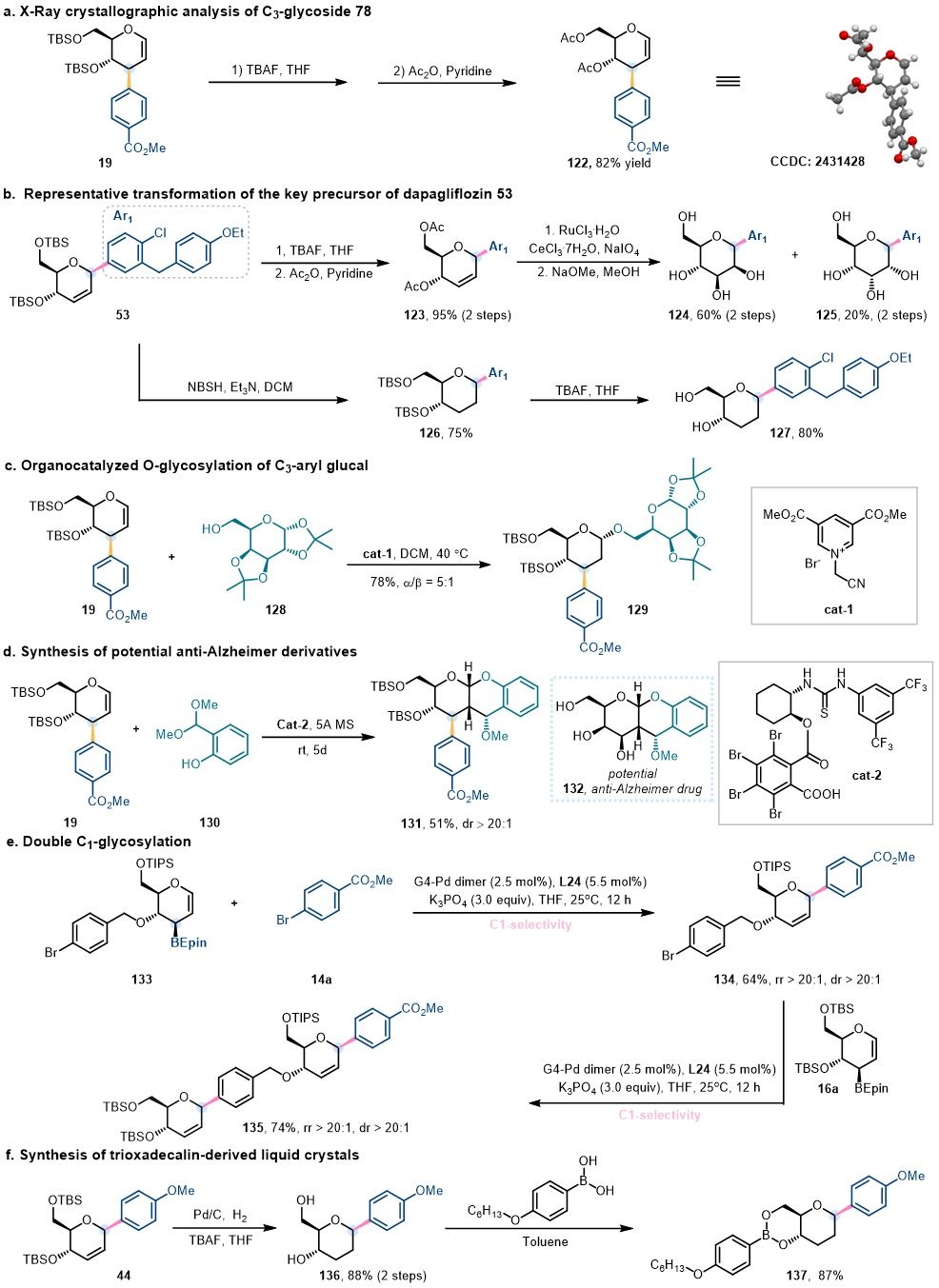
图9. 合成应用与转化 (图片来源:Angew Chem)
总结
糖类的可控发散性合成不仅是快速构建结构多样化糖分子库的关键策略,也是糖化学合成面临的核心挑战之一。然而,目前能够同时实现区域选择性和立体选择性精准控制的糖类合成体系仍极为稀缺。针对这一难题,上海交通大学朱峰课题组开发了首例钯催化、配体调控的区域发散性糖基Suzuki-Miyaura偶联反应(GSMC),实现了从3-硼酸酯糖烯出发,立体专一性地合成3-C-糖烯和2,3-不饱和C-糖苷。其创新性主要体现在以下三个方面:(1)设计并合成兼具反应性和稳定性的3-硼酸酯糖烯,作为全新的糖基供体;(2)建立了配体结构与区域选择性的定量关系模型;(3)通过DFT计算揭示了配体调控区域选择性的机理基础。该方法不仅高效合成了一系列2,3-不饱和C-糖苷,还精准构建了长期缺乏简洁合成途径的3-芳基/烯基糖烯。更为重要的是,该策略将糖苷键的高效构建与糖骨架的灵活修饰有机融合,为快速合成结构复杂、多样化的糖类化合物提供了全新的研究思路与方法学框架。
文章链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202511045








