

近日,上海交通大学变革性分子前沿科学中心马佳佳团队和欧柏林学院(Oberlin College) Shuming Chen 团队取得重要研究进展,研究成果分别以Half-Sandwich Ru(II) Complexes Featuring Metal-Centered Chirality: Configurational Stabilization by Ligand Design, Preparation via Kinetic Resolution, and Application in Asymmetric Catalysis和Accessing N-Unprotected Unnatural α-Amino Acid Esters by Half-Sandwich Chiral-at-Ruthenium Aldehyde Catalysis: Scope and Mechanistic Study为题发表于JACS和ACIE。
手性化学研究领域长期存在"重碳轻金"的现象。尽管对碳中心手性的研究已较为充分,但过渡金属手性这一极具潜力的领域却仍进展缓慢,亟待突破。相比碳元素,过渡金属元素的数量更加庞大、立体化学特征更加丰富,因此拥有更加广阔的手性化学空间,同样具备重要的研究价值(图1)。
导致金属手性研究滞后的主要原因可能是由于金属手性稳定性一般较差且金属手性分子缺乏高效的合成方法。以半夹心型金属手性络合物为例,自20世纪70年代以来,金属有机化学家对其金属手性的稳定性问题产生了大量的讨论和争辩(ref. EJIC 2001, 905)。并在21世纪初形成较为一致的结论,即Re、Mn、Fe等金属手性构型相对较稳定,而在合成化学领域更具应用价值的铂族金属(Ru, Rh, Ir等),却普遍存在手性构型稳定性不足的问题。以著名的Noyori-Ikariya催化剂为例,多项研究表明,金属Ru(II)中心手性的构型稳定性较差,在室温下即可发生显著的外消旋化。虽然通过对手性螯合配体的进一步改良可以提升铂族金属手性构型的稳定性(ref. JACS 2019, 7194; Science 2020, 1098; ACIE 2023, e202303709等),但仍缺乏系统性研究和较为通用的调控策略。
导致半夹心型络合物中金属手性构型稳定性较差的原因可能来自两方面(图3)。首先,金属参与形成配位键的键离解能(BDEs)(对于Ru-H/C/O为35−65 kcal/mol)远低于相应含碳共价键的键离解能(80−100 kcal/mol)。其次,配体解离后形成的配位不饱和中间体通常具有较低的翻转能垒,其快速翻转后配体重新配位形成另外一个对映异构体,从而导致外消旋化。
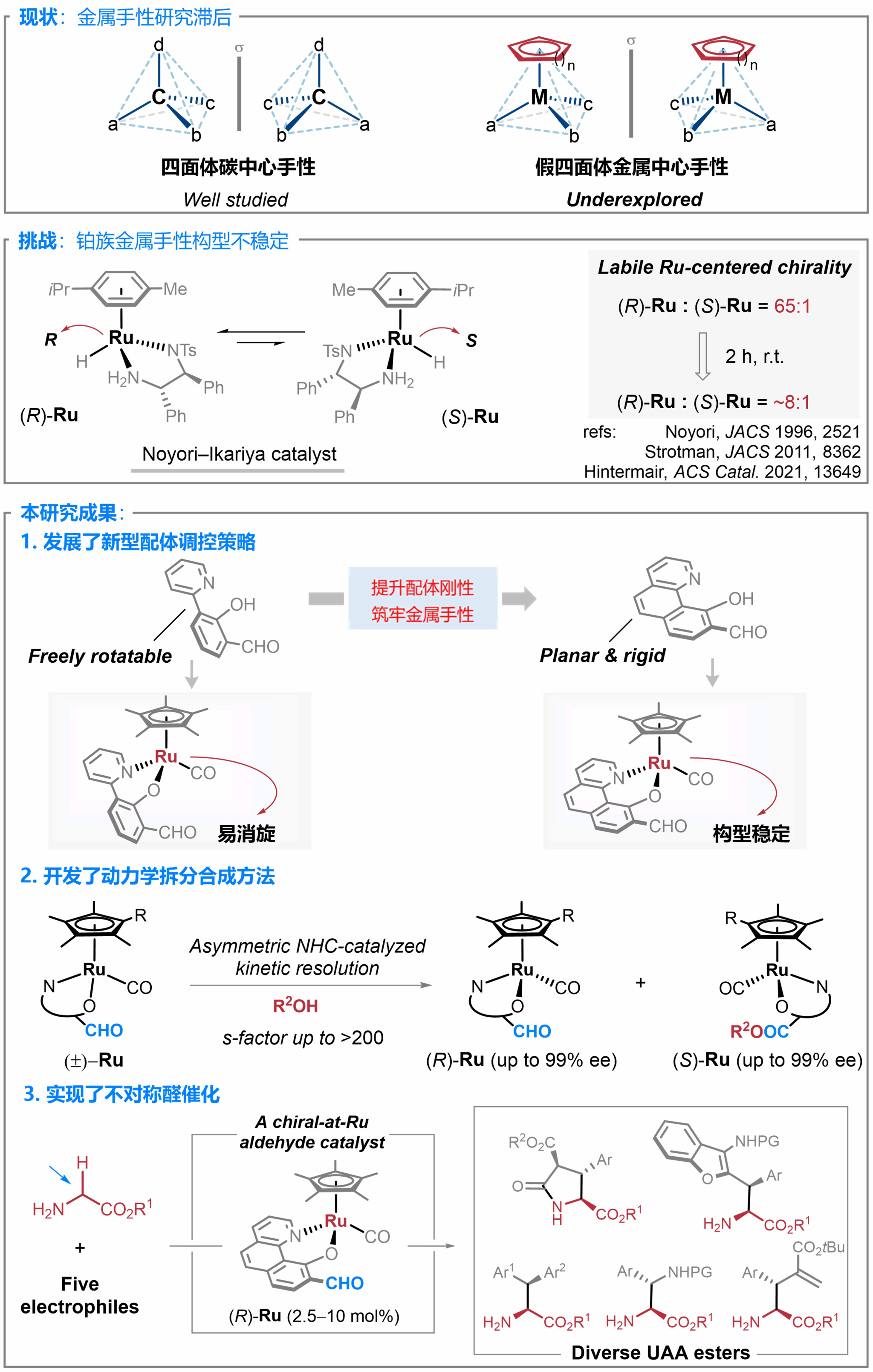
图 1. 研究背景与研究成果概览。
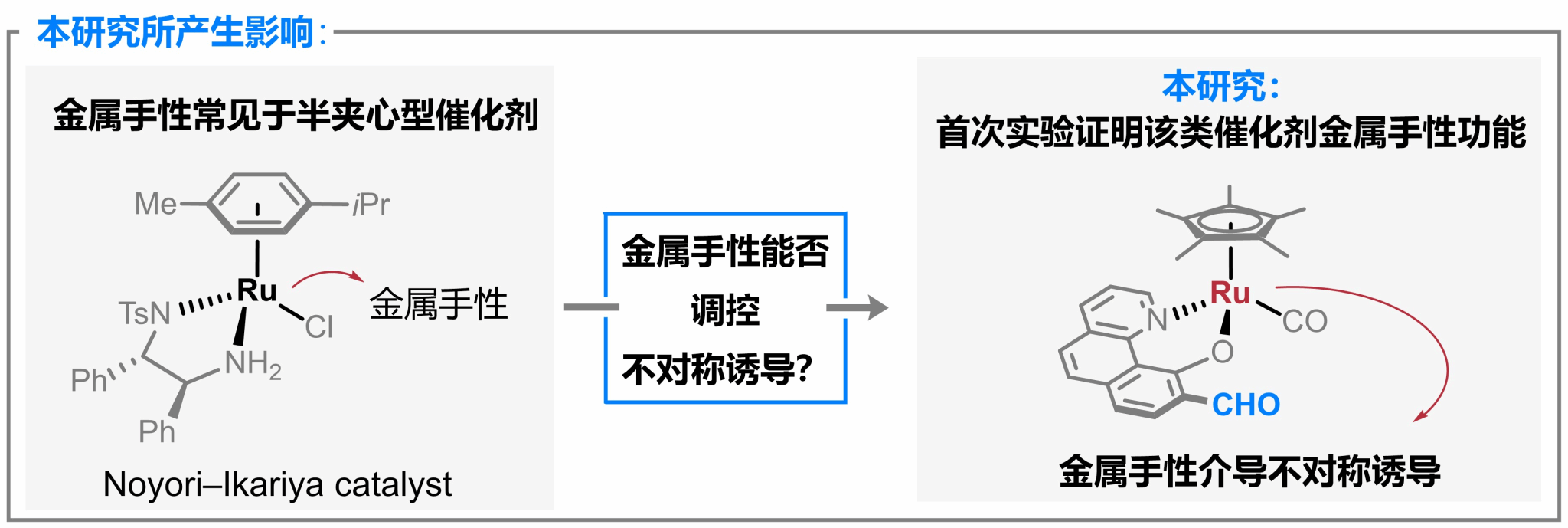
图 2. 本研究所产生的影响。
基于上述背景,上海交通大学变革性分子前沿科学中心马佳佳团队和欧柏林学院(Oberlin College) Shuming Chen 团队取得重要研究进展,报道了1)通过提升螯合双齿配体的刚性,能够显著增强半夹心型Ru络合物金属手性构型的稳定性;2)立足于这一调控策略,实现了半夹心型金属手性络合物的不对称催化合成;3)并进一步证明所获得金属手性络合物是一种高效的手性醛催化剂(图1)。
值得注意的是,尽管金属手性常见于半夹心型催化剂,但关于金属手性能否在催化反应过程中调控不对称诱导的研究还十分欠缺(图2)。本研究所开发的手性醛催化剂创新性地利用金属手性(而非传统配体手性)作为立体控制源,在甘氨酸酯的不对称转化中实现优异的手性控制。这一结果首次通过实验证实了半夹心型催化剂体系中金属手性在不对称诱导过程中的关键调控作用,为相关催化机制的研究提供了新视角。
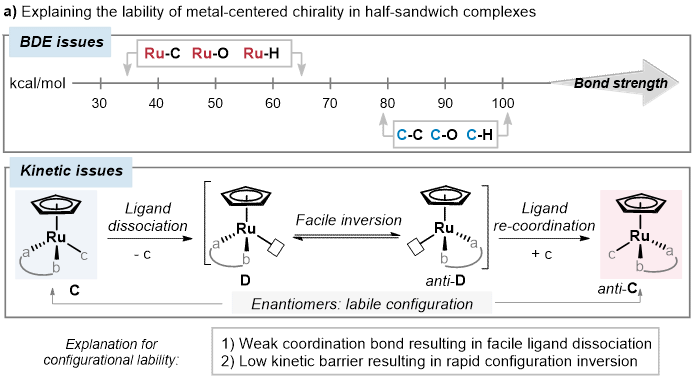
图 3. 半夹心型络合物金属中心手性构型不稳定的原因以及本文研究内容。图片来源于JACS
研究团队首先合成了一系列不同N,O-双齿配体配位的半夹心型钌络合物,并通过氮杂环卡宾(NHC)催化策略实现了R构型和S构型的动力学拆分。通过考察双齿配体对金属中心构型稳定性的影响,研究团队发现缩小双齿配体的二面角可以显著提升络合物的构型稳定性。平面化的苯并喹啉N,O-双齿配体配位形成的络合物(R)-1d在iPrOH中的消旋半衰期为40天,其构型稳定性远高于其它苯基-吡啶配位的钌络合物(图3)。
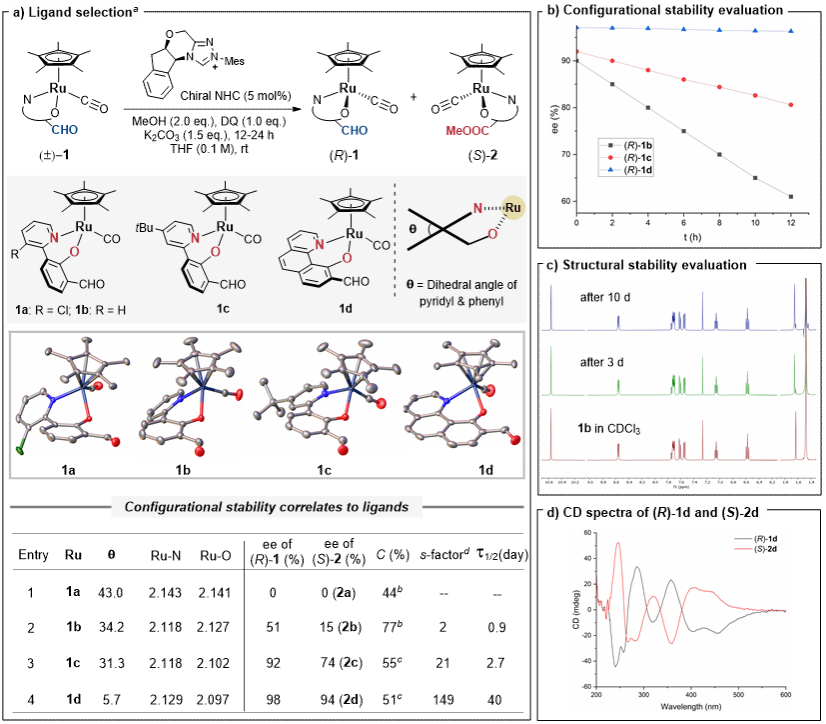
图 3.半夹心型钌(II)中心手性络合物的构型和化学稳定性评估
为了进一步揭示双齿配体二面角与络合物构型稳定性之间的内在联系,研究团队通过DFT计算考察了消旋化过程中配体几何构型变化所引起的能量变化。首先,研究团队计算了络合物1a–d及其对应消旋过渡态TS-1a–d中每个双齿配体片段的能量。然后,将这些值与相对应自由阴离子配体1a–d-lig的能量进行比较,从而分别获得了配体在配位和消旋过程中因几何构型变化所引起的能量变化(ΔEdist)。研究发现,柔性的苯基-吡啶类配体1a-lig、1b-lig和1c-lig在配位过程中二面角存在较大变化,因而扭转能(ΔEdist)较大。而这部分扭转能降低了配体解离过渡态TS-1a–c的能垒,有利于络合物的消旋化过程。刚性的苯并喹啉配体阴离子1d-lig二面角为0°,且在形成络合物1d与解离过渡态TS-1d中的扭转能(ΔEdist)较小。这使得络合物(R)-1d在配体解离时能垒高达26.9 kcal/mol,因而具有更好的构型稳定性(图4)。
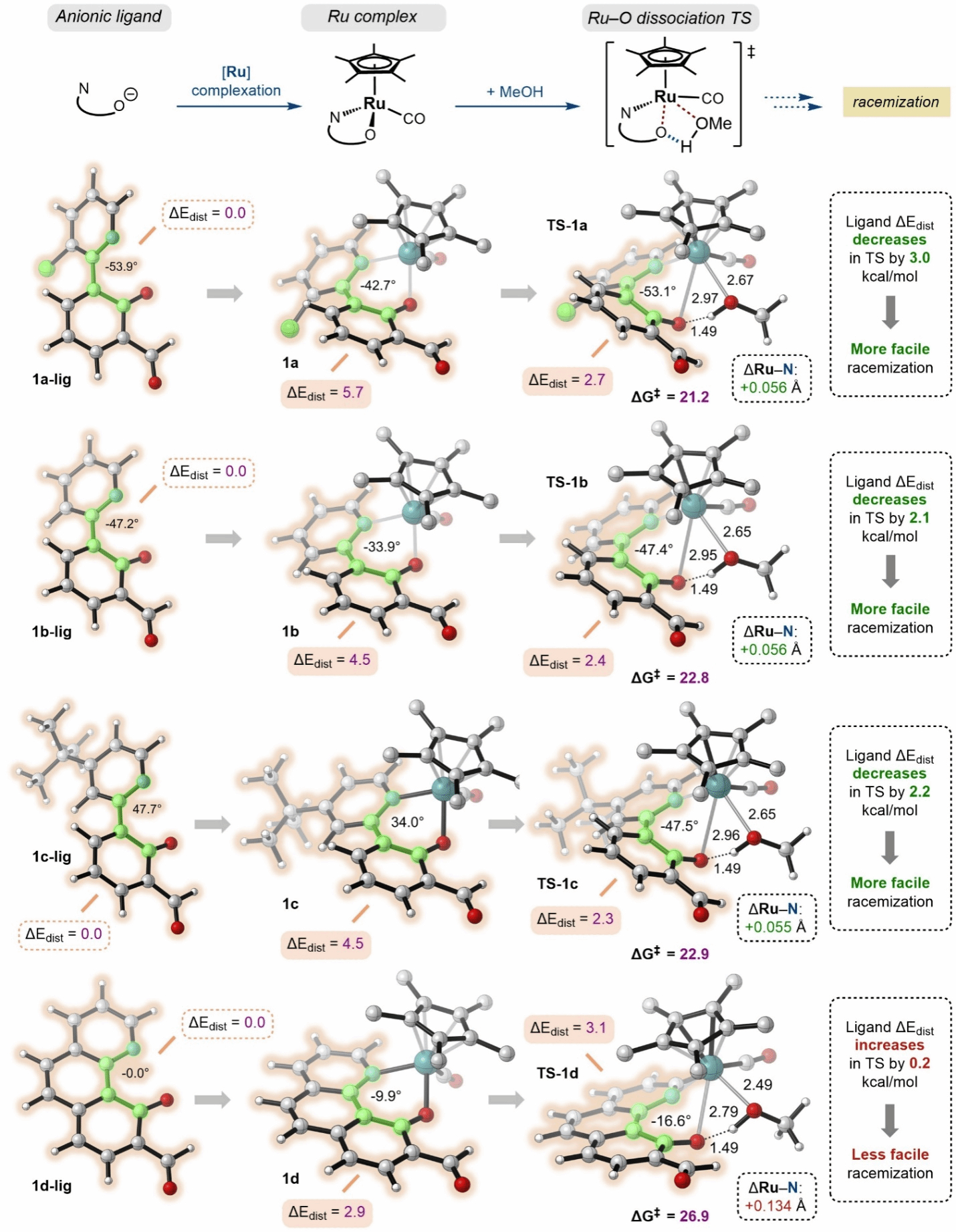
图 4. DFT计算考察配体几何构型变化与络合物构型稳定性的关系
在确定了平面的苯并喹啉衍生物作为最佳配体后,研究团队接下来评估了NHC催化动力学拆分(KR)的通用性和适用范围。如图5所示,研究团队首先研究了反应对醇的适用范围,发现多种不同类型的醇都能与该动力学拆分反应兼容,最终高效拆分得到R构型的原料和S构型的酯类化合物。接下来,研究团队考察了苯并喹啉配体上取代基对拆分效率的影响。结果表明该方法对甲基、甲氧基、硝基、苯基、炔基和溴原子等取代基均有良好的耐受性。同时,反应对环戊二烯基上甲基的个数并不敏感,并且对异丙基和环己烷基等位阻较大的基团也能兼容。
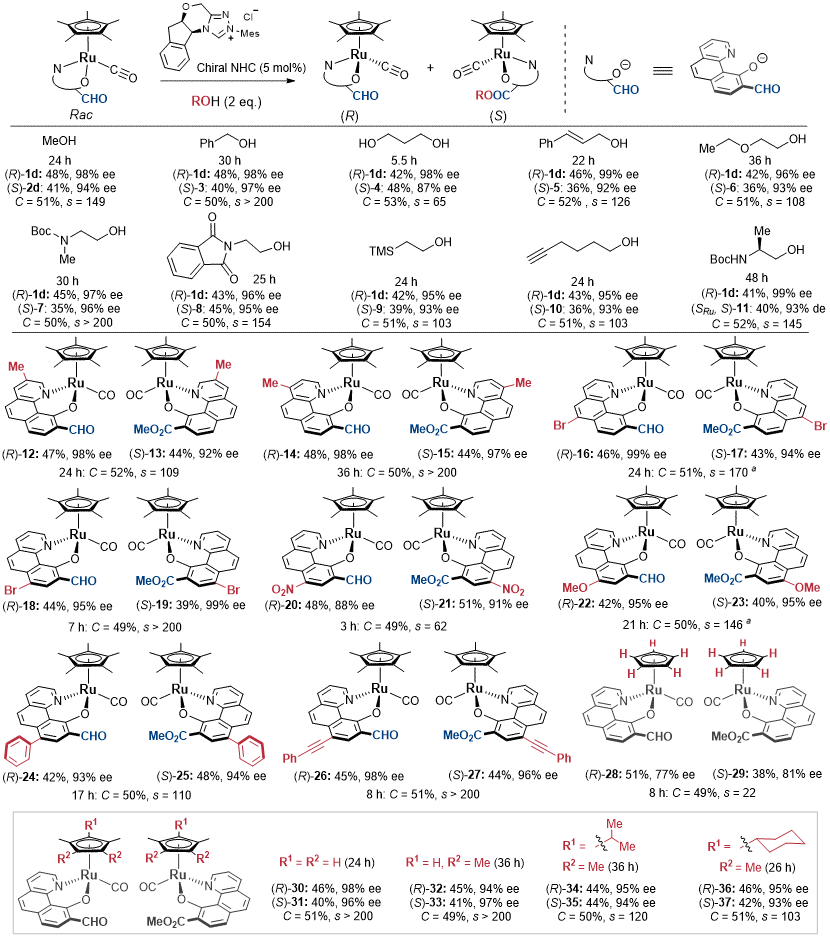
图 5. NHC催化的动力学拆分反应的通用性和适用范围考察
接下来,为获得更多样化的半夹心型手性钌配合物,研究团队对(R)-1d进行了进一步的合成转化(图6a)。在非手性NHC催化的条件下,(R)-1d可以顺利被转化为相应的酯或羧酸。另外,(R)-1d可以通过与羟胺或Wittig-Horner试剂缩合分别得到相应的肟和共轭烯烃。上述转化反应的产物ee值均没有出现明显降低,这也在某种程度上证明了(R)-1d良好的构型稳定性。受郭其祥教授、赵宝国教授等人在手性醛催化领域相关工作的启发(Nat. Commun. 2020, 5372; Acc. Chem. Res. 2023, 1097; Acc. Chem. Res. 2024, 776),研究团队也尝试了用该半夹心型手性醛(R)-1d催化甘氨酸酯和对亚甲基苯醌之间的不对称加成反应。令人欣慰的是,该半夹心型手性醛能催化反应以>19:1的dr值和99% ee值得到1,6-加成产物(图6b)。这一研究成果证明了该半夹心型配合物中的金属手性中心可以实现高效的不对称诱导。
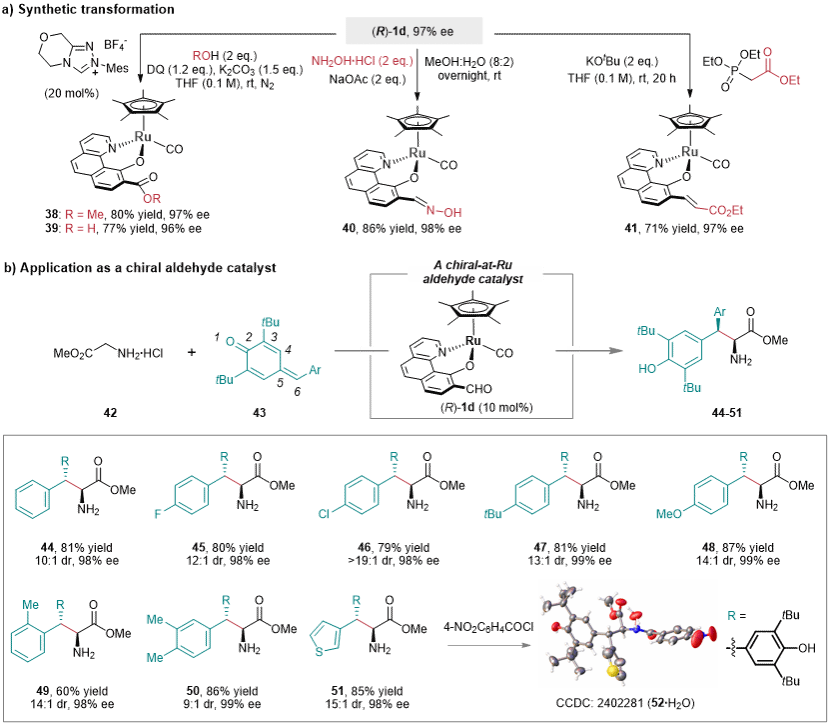
图 6. 合成转化与应用
小结
研究团队立足于配体二面角调控金属构型稳定性的新策略,通过NHC催化的动力学拆分反应,成功实现了半夹心型钌(II)络合物的高效不对称合成,并验证了相应手性络合物为高效不对称催化剂。上海交通大学马佳佳副教授和欧柏林学院(Oberlin College) Shuming Chen 助理教授为该论文共同通讯作者;上海交通大学博士后梁辉、博士研究生陈港和欧柏林学院(Oberlin College)本科生Gabriel N. Morais为两篇论文第一作者。该项工作得到了科技部重点研发计划、国家自然科学基金和上海市科委面上项目的经费支持。
导师介绍
马佳佳,上海交通大学变革性分子前沿科学中心课题组长,长聘教轨副教授,博士生导师,国家海外高层次青年人才计划入选者(2021)。2011年本科毕业于西北农林科技大学,之后分别于厦门大学和德国马尔堡大学获得硕士 (2014年,导师:Prof. Eric Meggers与龚磊教授) 及博士学位 (2018年,导师:Prof. Eric Meggers)。2018至2021年,于德国明斯特大学开展博士后研究,合作导师为德国科学院院士 Prof. Frank Glorius。2021年底入职上海交通大学,课题组研究方向主要集中在金属手性络合物的设计、制备及其催化功能开发。
在过去三年中,我们已经成功开发了多种新型金属手性络合物,并验证了它们在催化反应中的独特性能。课题组仍有2026年春季/秋季入学的博士生名额,欢迎拥有合成方法学、全合成和不对称合成等领域研究背景的同学加入我们团队。
课题组网站:https://jiajiamagroup.sjtu.edu.cn/
文章链接:








