

肿瘤细胞的DNA损伤修复机制引发的放疗抵抗显著削弱了其放疗效果,尤其是同源重组(HR)和非同源末端连接(NHEJ)等修复途径。在临床分割放疗过程中,肿瘤细胞的DNA损伤修复能力逐渐增强,导致治疗诱导的放疗抵抗,最终可能导致放疗失败。尽管已有研究通过设计基于高Z元素的纳米放射增敏剂,并试图通过抑制HR或NHEJ修复途径诱导DNA损伤以增强放疗效果。然而,肿瘤细胞仍可以通过多种替代修复途径来修复损伤的DNA。DNA连接是所有DNA损伤修复途径中的关键步骤。值得注意的是,相邻3′-羟基和5′-磷酸末端是连接的DNA缺口的必需基团。因此,对5′-磷酸末端进行去磷酸化调控是阻止DNA连接的潜在策略。近年来,具有类酶活性的人工纳米酶在放疗领域引起了广泛关注。特别是氧化铈纳米酶,其具有可逆的氧化还原对和表面氧空穴,不仅可以通过类过氧化氢酶(CAT)活性缓解肿瘤缺氧,还可以通过类磷酸酶活性催化磷酸化底物去磷酸化。然而,其类磷酸酶活性受到非特异性DNA配位限制,显著降低了氧化铈纳米酶表面亲核试剂的亲核性。因此,基于氧化铈纳米酶设计构建可以提升亲核试剂亲核能力的纳米放射增敏剂,旨在靶向细胞核并有效使断裂的DNA缺口去磷酸化以阻断DNA连接,有望克服放疗抵抗。
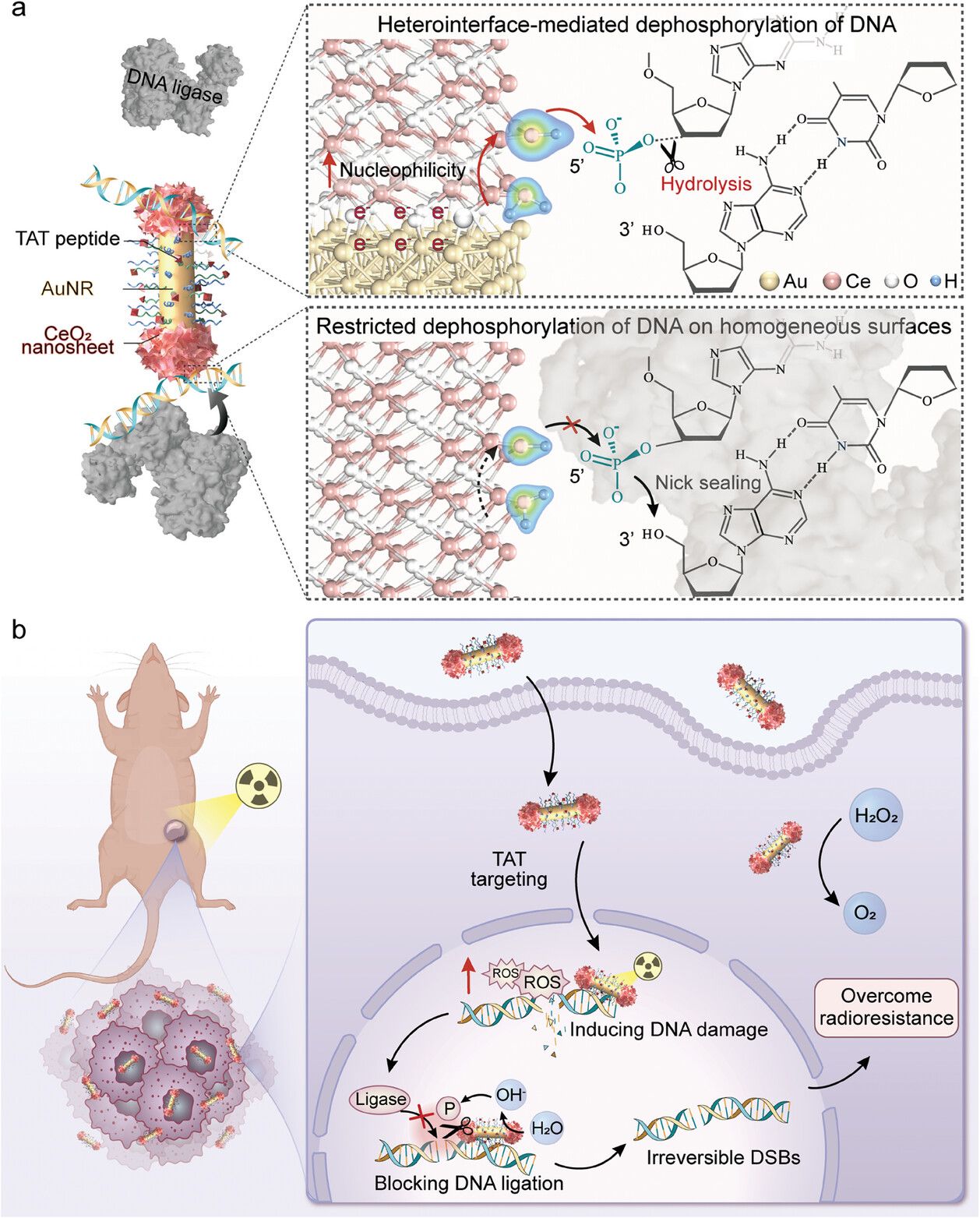
近日,上海交通大学变革性分子前沿科学中心凌代舜教授团队和上海交通大学医学院李方园教授团队在Advanced Materials在线发表题为“A Nucleophilicity-Engineered DNA Ligation Blockade Nanoradiosensitizer Induces Irreversible DNA Damage to Overcome Cancer Radioresistance”的研究论文。该研究开发了一种新型的核靶向DNA连接阻断的纳米放射增敏剂(DLBN),其可以缓解乏氧并增强辐射诱导的活性氧(ROS)产生,放大辐射诱导的DNA损伤;同时,通过Au/CeO2异质界面形成具有更高亲核能力的羟基,使核内DNA缺口去磷酸化,抑制DNA连接过程,进而阻断所有DNA损伤修复途径,以克服放射抵抗并提高放疗效果。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202410031








