

长期以来,人们通过手术、化疗、放疗和靶向药物等策略来治疗肿瘤,主要聚焦于肿瘤细胞的直接杀伤,不可避免地带来肿瘤耐药和治疗副作用等问题。近年来,通过免疫检查点抑制剂和嵌合抗原受体 T(CAR-T)细胞治疗等免疫疗法调动免疫系统,来识别和消除肿瘤细胞,展现出改变恶性肿瘤治疗格局的潜力。免疫治疗中的免疫检查激动剂通过增强免疫细胞的活性,激活免疫系统发挥抗肿瘤作用。目前,针对GITR、OX40和STING等通路的免疫激动剂正在临床试验阶段。而目前已有免疫激动剂存在免疫系统过度激活、不同患者个体化差异大、精准治疗药物开发难度高等问题,导致临床受益患者的比例仍然较低。代谢异常是肿瘤发生和发展的普遍且关键特征。目前,一些抗肿瘤代谢药物通过调控肿瘤异常代谢通路,能够一定程度抑制肿瘤生长。然而,现有代谢治疗药物存在体内半衰期短、脱靶效应明显和容易干扰正常细胞代谢等问题。
近日,上海交通大学变革性分子前沿科学中心凌代舜教授团队和上海交通大学医学院李方园教授团队合作,在《Nature Nanotechnology》发表题为“An artificial metabzyme for tumour-cell-specific metabolic therapy”的研究论文。该研究首次聚焦肿瘤广谱代谢标志物作为代谢免疫检查点,提出全新的肿瘤代谢激活免疫治疗策略;团队创新合成了一种模拟黄嘌呤氧化酶(xanthine oxidoreductase,XOR)中铁和四面体钼原子构象的的FeMoO4生命体系催化剂,称为“人工代谢酶”。该人工代谢酶能够催化肿瘤细胞内黄嘌呤转化为尿酸;尿酸分子作为新的“定位和激活信号”,实现激活免疫系统的功能,诱导其附近的巨噬细胞向M1表型极化,使其特异性识别并吞噬肿瘤细胞,从而精准地实现肿瘤特异性的代谢激活免疫治疗(图1)。有趣的是,这种代谢调节促进了肿瘤细胞间代谢与免疫系统的相互作用,从而引发免疫细胞对肿瘤细胞的协同攻击——这是一种化学生物学驱动肿瘤细胞特异性代谢激活免疫治疗的范式创新。该人工代谢酶展示了在生命体系代谢画布上靶向改造肿瘤细胞的潜力,将肿瘤细胞自己定位为一个燃烧的“火花”来刺激免疫系统的定点激活。
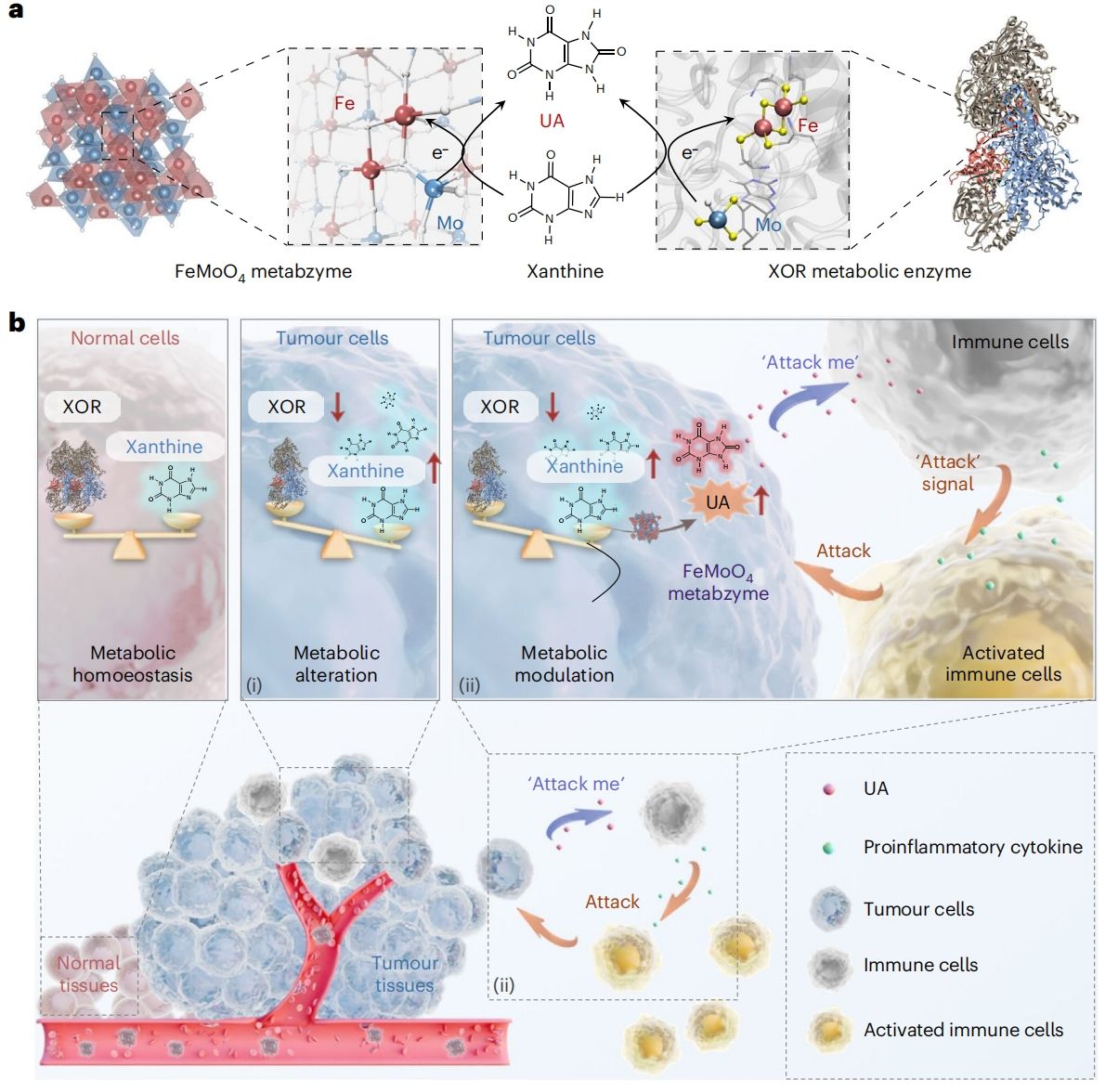
图1. FeMoO4人工代谢酶用于肿瘤细胞特异性代谢激活免疫治疗。
为了仿生模拟XOR中Mo和Fe辅因子结构,作者发展了一种“溶蚀-吸附-锚定”单原子界面工程技术,基于MoO3-x基质实现Fe单原子可控掺杂,Fe原子掺杂比例可高达20.72 wt%。通过控制Fe原子掺杂过程中的晶格重构,作者成功构建了具备类XOR金属原子催化构象(Fe2+和四面体Mo4+活性中心)和催化活性(黄嘌呤→尿酸)的FeMoO4人工代谢酶(图2)。
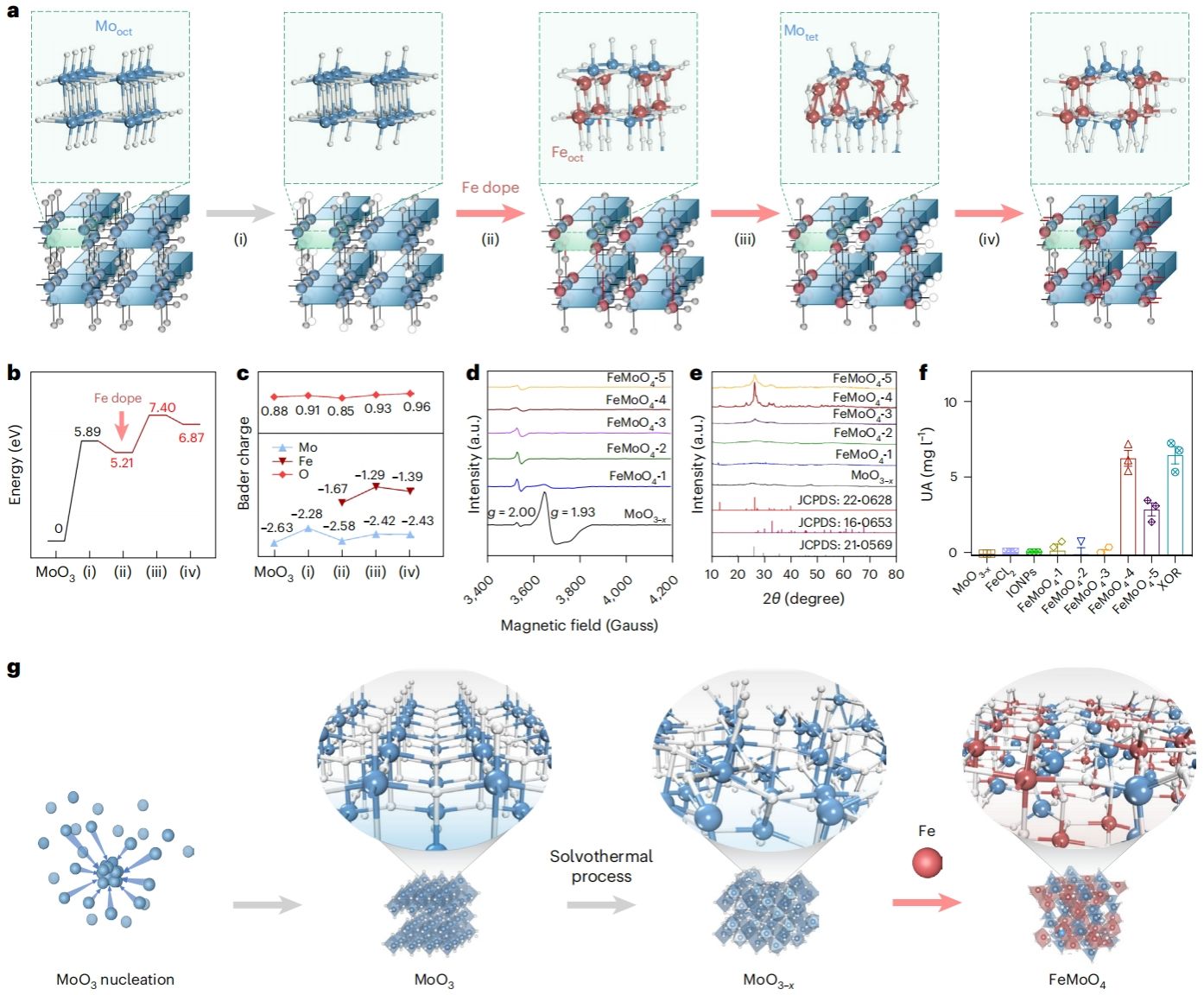
图2. FeMoO4人工代谢酶的设计与构建。
作者通过透射电镜、元素分析、球差电镜和同步辐射等手段,证实了Fe以单原子形式均匀分布在FeMoO4人工代谢酶结构中。研究还发现,FeMoO4人工代谢酶中Fe和Mo元素价态分别为Fe2+/Fe3+和Mo4+/Mo5+/Mo6+;此外,Fe的掺杂显著提高了Fe-O-Mo的电子转移效率,为在生命体系高效催化肿瘤细胞代谢产物黄嘌呤奠定了理化结构基础(图3)。
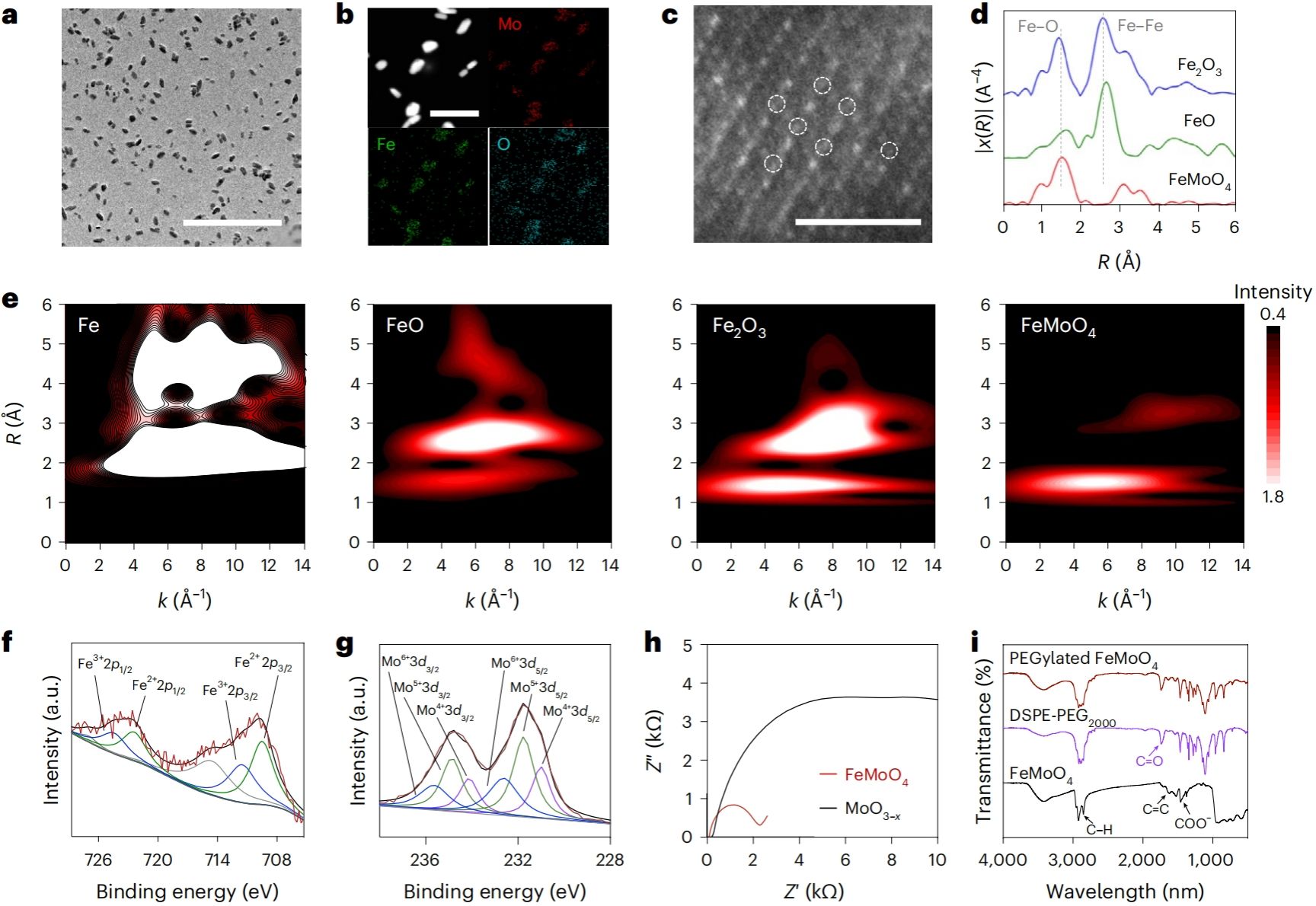
图3. FeMoO4人工代谢酶的理化性质分析。
作者通过密度泛函理论(DFT)计算发现,FeMoO4人工代谢酶通过与氢氧根反应形成OH–Mo–O–Fe复合结构,该复合物有助于黄嘌呤的质子转移,从而降低反应能垒,提高尿酸的产生效率。此外,Fe原子掺杂引起的MoO3–x晶格重排,显著提高了FeMoO4人工代谢酶对黄嘌呤底物的吸附能力和表面电子活性,这在黄嘌呤转化为尿酸的催化过程中起到了关键作用(图4)。
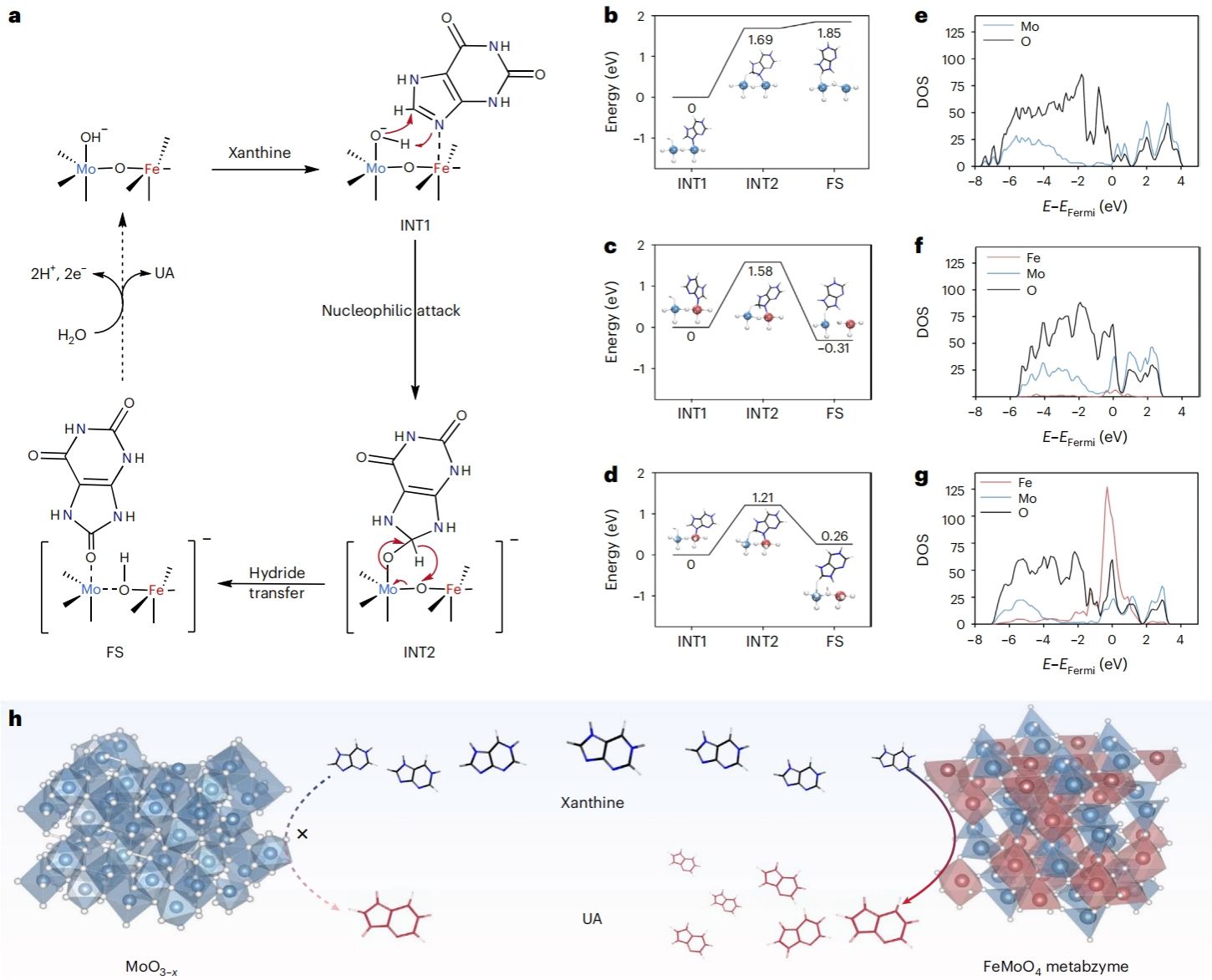
图4. XOR类酶催化活性机制研究。
作者在细胞和动物层面探究了FeMoO4人工代谢酶的代谢调控性能。FeMoO4人工代谢酶在入胞后不会直接杀伤肿瘤细胞,仅仅是将肿瘤细胞内黄嘌呤催化为尿酸。而尿酸分子作为“定位和激活信号”诱导邻近的巨噬细胞向M1表型极化,并激活NLRP3/IL-1β通路,从而使巨噬细胞能够识别并吞噬“被定位”的肿瘤细胞。作者进一步构建了B16F10荷瘤小鼠模型,并发现肿瘤组织中黄嘌呤含量显著高于正常组织,这为FeMoO4人工代谢酶的肿瘤选择性代谢调控奠定了生物学基础。通过空间代谢组学等技术,作者证实了经静脉注射FeMoO4人工代谢酶后,肿瘤组织中尿酸水平显著升高,且这一变化与FeMoO4人工代谢酶在肿瘤组织中的时空分布高度一致(图5)。
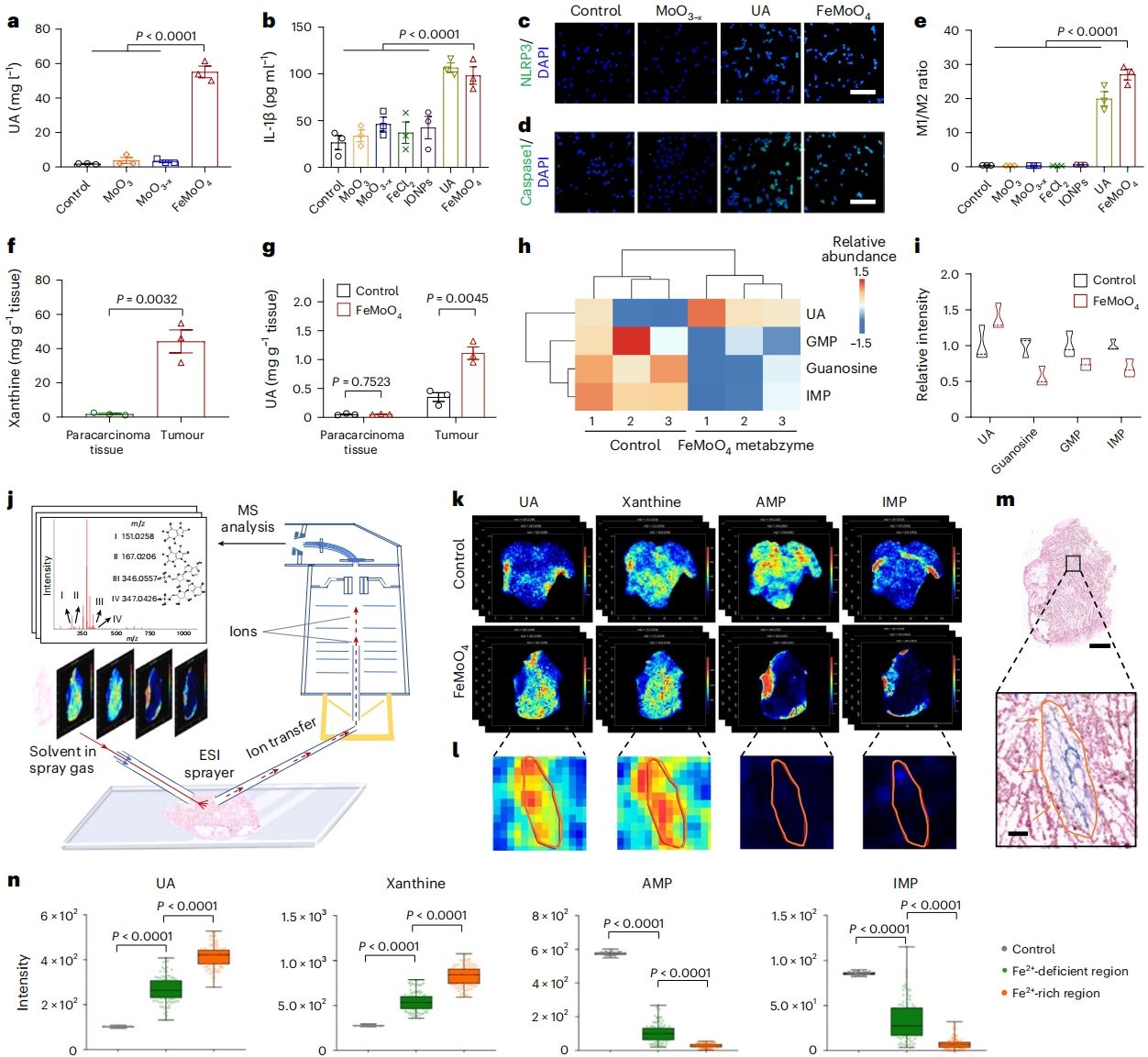
图5. FeMoO4人工代谢酶活体代谢调控研究。
更令人振奋的是,FeMoO4人工代谢酶能够有效抑制B16F10肿瘤的生长。通过流式细胞术和质谱流式分析等技术,作者发现FeMoO4人工代谢酶显著提高了肿瘤组织中M1型巨噬细胞、CD8+ T细胞、CD4+ T细胞和成熟树突状细胞(DCs)的比例,同时上调了IL-1β、TNF-α和IL-12等促炎细胞因子的水平。根据上述结果,作者得出结论:尿酸分子作为“定位和激活信号”介导肿瘤细胞与免疫细胞的之间的相互作用:1)尿酸诱导邻近的巨噬细胞向M1表型极化,并激活NLRP3/IL-1β通路,从而使巨噬细胞能够识别并吞噬“被定位”的肿瘤细胞;2)尿酸和促炎细胞因子IL-1β能够增强DCs和T细胞等免疫细胞活性,从而特异性激发抗肿瘤免疫应答。此外,FeMoO4人工代谢酶与PD-1单抗联用能够更有效地抑制肿瘤生长,并延长小鼠的生存期(图6)。
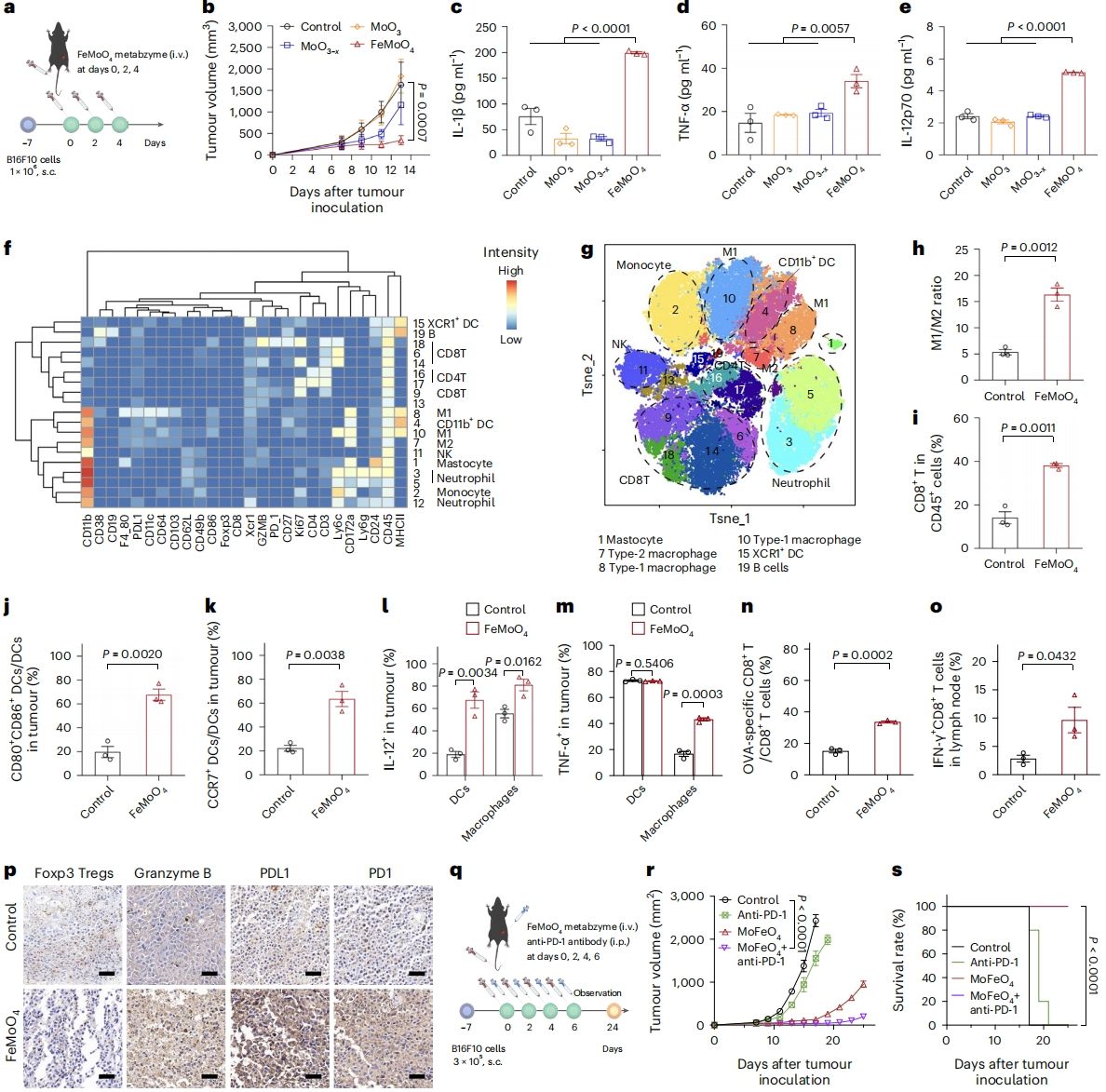
图6. FeMoO4人工代谢酶介导肿瘤特异性代谢激活免疫治疗。
这项研究聚焦天然代谢酶人工模拟和肿瘤-免疫细胞互作调控,合成特定调控代谢通路和代谢产物的人工代谢酶,提出一种新型代谢免疫检查激动策略,为代谢异常相关重大疾病(包括肿瘤、心血管疾病、痛风、糖尿病等)提供基于人工代谢酶的全新代谢免疫调控策略,开创化学生物学驱动的精准代谢治疗新范式。
该工作得到了上海交通大学樊春海院士的建议和帮助,后继将依托上海交通大学转化医学国家科学中心平台,进行成果的临床转化研究。研究得到了国家重点研发计划、国家自然科学基金、上海市"科技创新行动计划"系列项目的共同资助和支持。
原文链接:https://www.nature.com/articles/s41565-024-01733-y








