

核酸感应受体(NA-sensing receptors)是一类重要的先天免疫受体,其对于维持细胞和机体的稳态尤为重要。针对核酸感应受体的配体(ligands)开发,可以实现先天免疫系统的可控激活,在抗病毒和抗肿瘤领域有着重要应用。然而,复杂的核酸感应调控机制,对核酸类配体的靶向递送、原位有效浓度和可控的免疫原性提出了很高要求。首先,核酸感应受体的区室化分布,要求核酸配体实现细胞器水平的精准递送。例如Toll样受体(TLRs)大多分布在细胞膜或者内体(溶酶体)中,而cGAS-STING、RIG-I等通路需要配体在细胞内进行激活。其次,核酸类配体可能被核酸酶或者特定细胞器加工降解,这直接影响到配体的局部有效浓度和可利用性,从而影响到受体的识别和激活。最后,核酸识别受体在不同免疫细胞的表达差异和下游信号串扰,也对核酸配体的可控免疫原性和安全性,提出了更高的要求。
大于40 bp的双链RNA是TLR3的配体,可以实现TLR3的二聚化。使用长双链RNA或者其类似物,如聚肌苷酸胞苷酸(polyIC),可以实现TLR3通路的激活。然而,这些RNA配体容易被血液和组织中的RNA酶解,影响了它们的生物医学应用。同时,polyIC的分子量分布宽,呈现出不均一的物化性质,同时会串扰其他免疫通路,带来了安全风险,限制了其临床收益。因此,亟需一种TLR3新型的免疫激活剂(佐剂)的额策略,以实现高效、安全、可控地TLR3激活。
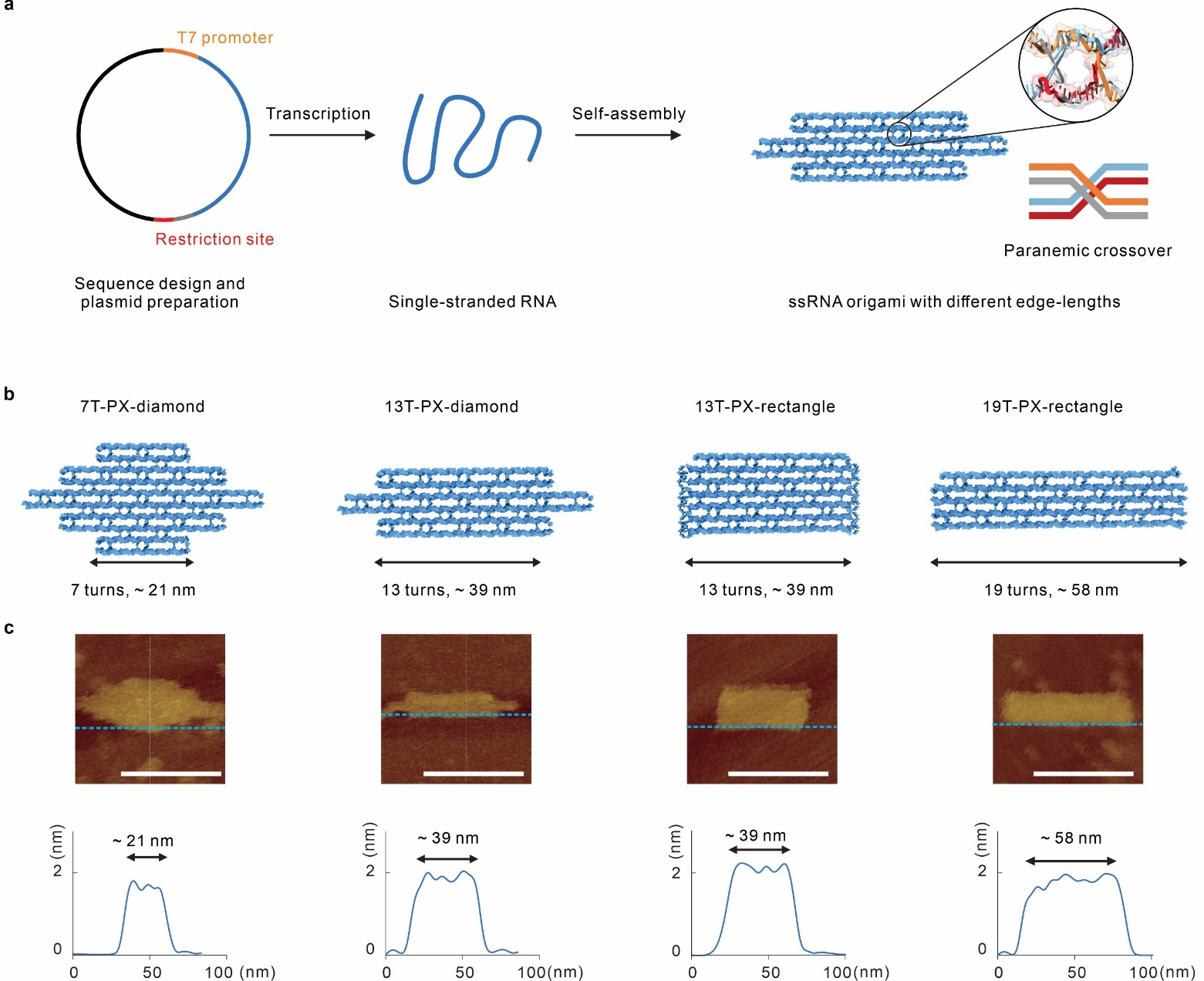
图1 单链RNA折纸的合成与表征
针对以上问题,上海交通大学变革性分子前沿科学中心姚广保副教授、樊春海院士,联合上海交通大学医学院附属仁济医院刘颖斌课题组、亚利桑那州立大学颜颢课题组提出了一种基于单链RNA折纸的新型TLR3免疫佐剂的设计策略。单链RNA折纸可以调控形状和尺寸,具有良好的生物稳定性、细胞器靶向性和可控的免疫原性,实现了TLR3的可预测地激活。这一策略为后续靶向核酸受体的配体设计提供了参考。
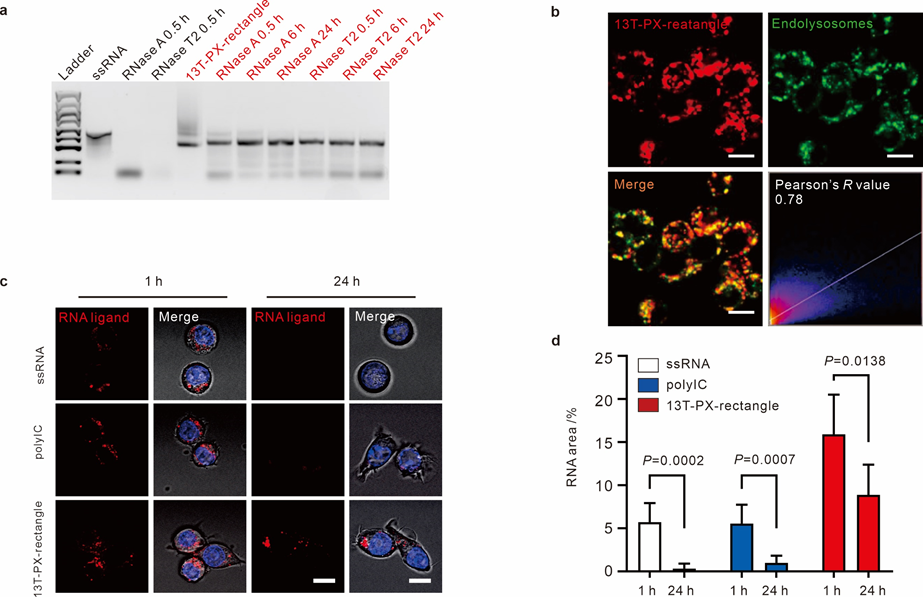
图2 单链RNA折纸展现良好的生物稳定性和内体溶酶体滞留能力
研究人员设计了不同形状和不同边长的单链RNA折纸。单链RNA折纸内部的P型交叉(paranemic-crossover)结构,大大提升了其抗RNA酶降解的能力,并提升了RNA折纸在内体溶酶体中的滞留时间,这也为后续TLR3的持续激活提供了基础。

图3 调控单链RNA折纸边长实现可控的先天免疫激活
随后,研究人员发现,调控单链RNA折纸的边长,可以控制RNA折纸与TLR3的相互作用,进一步地会影响到巨噬细胞的激活状态。边长为77 bp的单链RNA折纸,与TLR3的相互作用较弱,其巨噬细胞的激活能力不高。而长边长(143 bp 和 209 bp)的单链RNA折纸,可以与TLR3形成更大的聚集体,同时也可以更有效地激活巨噬细胞。巨噬细胞的激活程度,与单链RNA折纸的边长呈现正相关。

图4 单链RNA折纸联合PD-L1抗体实现肿瘤免疫治疗
在分子和细胞实验的基础上,研究人员选取长边长的单链RNA作为新型佐剂,进一步在小鼠活体上,验证单链RNA折纸作为新型免疫佐剂的潜力。研究人员通过瘤内注射的方式,将209 bp的长方形单链RNA折纸注射到荷瘤小鼠体内,并使用单细胞测序(scRNA-seq)技术,分析比较实体瘤内免疫微环境中,先天免疫细胞的变化。研究人员发现,注射过单链RNA折纸的小鼠肿瘤中,相较空白组和polyIC实验组,有着更多激活的巨噬细胞和中心粒细胞,这些细胞展现出抗肿瘤的功能。最后,作者将单链RNA折纸联合PD-L1抗体,在小鼠胰腺癌皮下瘤模型上进行验证,发现单链RNA折纸可以联合PD-L1抗体,有效地实现肿瘤生长抑制。
相关研究成果以“Edge Length-Programmed Single-Stranded RNA Origami for Predictive Innate Immune Activation and Therapy”为题发表在Journal of the American Chemical Society (美国化学会会刊)上,第一作者为上海交通大学化学化工学院、变革性分子前沿科学中心博士生戴琨。第一通讯单位为上海交通大学化学化工学院、变革性分子前沿科学中心。
文章信息:
Kun Dai, Yang Xu, Yang Yang, Jianfeng Shen, Xiaoguo Liu, Xinyi Tu, Lu Yu, Xiaodong Qi, Jiang Li, Lihua Wang, Xiaolei Zuo, Yingbin Liu*, Hao Yan*, Chunhai Fan*, Guangbao Yao*, Edge Length-Programmed Single-Stranded RNA Origami for Predictive Innate Immune Activation and Therapy. J. Am. Chem. Soc. 2023, .








